医薬品の原薬について
1.医薬品の原薬とは
原薬とは、「医薬品の生産に使用することを目的とする物質または物質の混合物で、医薬品の製造に使用されたときに有効成分となるもの」(平成13年11月2日医薬発第1200号厚生労働省医薬局長通知)と定義されています。承認制度においては、製剤の製造専用の原薬は、医療機関、薬局、販売業者、動物診療所等に販売又は授与されるべきものではなく製造販売を行う対象ではないとされていることから、原薬単独では医薬品医療機器法の製造販売承認の対象にはなりません。しかしながら、原薬の品質・規格・製造方法等については、医薬品製剤メーカー(製造販売業者)が行う製剤の承認申請の際に医薬品医療機器総合機構(PMDA)において厳格な審査が行われます。つまり、承認された製剤に使用される原薬の品質の確保についても、製剤の製造販売を行う製造販売業者が責任を有することになります。医療用医薬品であるジェネリック医薬品についても、その使用されている原薬についてはPMDAによる厳格な審査が行われています。
2.原薬供給の現状について(考え方と現状)
かつては、先発医薬品より薬価が低く抑えられているジェネリック医薬品については、海外の粗悪な原薬を使用しているのではないかとの疑念も少なくありませんでした。この点については以下のことから、そのようなことはないことがご理解頂けると思います。
ジェネリック医薬品の承認申請時の審査段階では、原薬及び製剤の品質が先発医薬品と同等またはそれ以上であることを申請時に提出された資料やデータに基づき調査・審査が行われ、確認が行われた後に製造販売が可能となるように承認されます。その際、例えば原薬の純度に関しては、医薬品調和規制国際会議(ICH)の合意に基づく「新規有効性成分のうち原薬の不純物に関するガイドライン」が、先発医薬品と同様にジェネリック医薬品にもそのまま適用されています。また、製造施設については、先発医薬品、ジェネリック医薬品を問わず、国が定めた「医薬品及び医薬部外品の製造管理及び品質管理に関する基準」(GMP省令)に適合した国内外の施設で製造され、同基準に従った管理が求められています。これらの確認は、原薬についても同様に確認されており、例えば、原薬を製造している国内外の原薬製造施設に対し、国、県、PMDAにより、直接製造施設に出向いた調査や確認(査察)が行われ、GMP遵守状況が確認されています。 このように、原薬が製造された製造国や製造工場が海外であったとしても、先発医薬品の品質と同等以上のジェネリック医薬品が承認、流通する制度が機能しています。
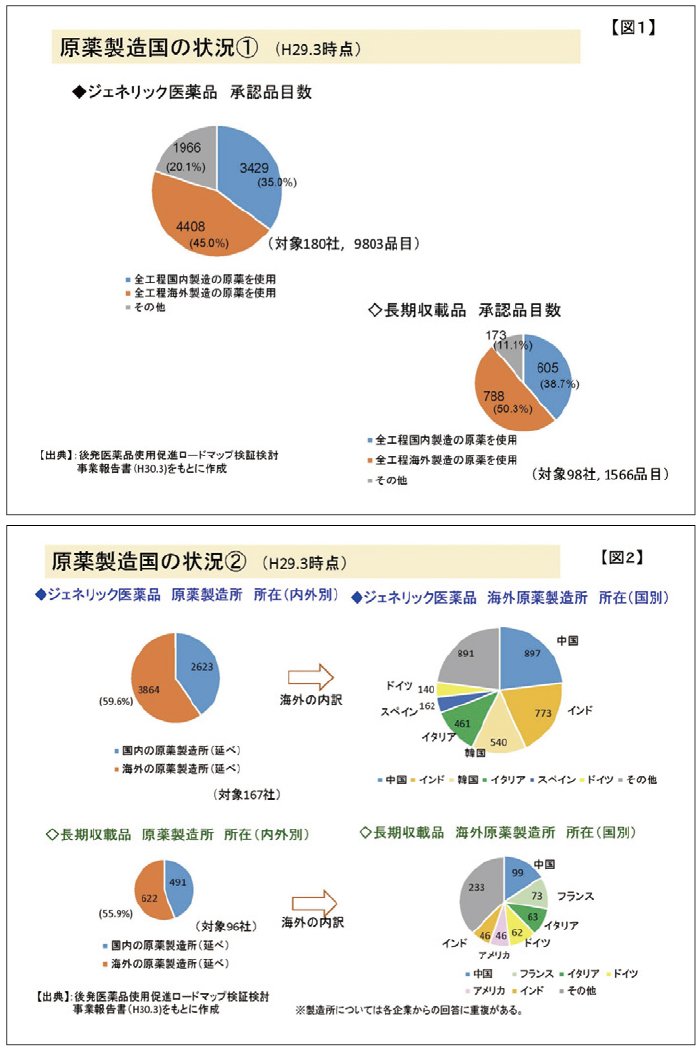
原薬の製造国の状況をジェネリック医薬品と先発医薬品(長期収載品)で比較した資料がありますので、図1、2にご紹介いたします。いずれも厚生労働省資料をもとに作成したものです。図1によれば、調査対象のジェネリック医薬品9,803品目、長期収載品 1,566品目のなかで、海外で製造された原薬を使用する品目数は、ジェネリック医薬品4,408品目(45.0%)と長期収載品788品目(50.3%)ですが、それぞれの使用割合については大きな差はありません。図2は、日本国内に供給されているジェネリック医薬品、長期収載品の原薬の製造所の所在国を調査したものです。原薬製造施設の国内、国外の比率はジェネリック医薬品59.6%、長期収載品55.9%となっております。ジェネリック医薬品、長期収載品とも原薬は国外製造施設で製造された比率が高いことが分かります。特に、ジェネリック医薬品、長期収載品を問わず、原薬製造施設は中国の製造施設が多くなっています。
3.ジェネリック医薬品の原薬製造国公開について
前述のとおり、医療用医薬品の原薬は海外原薬製造施設で製造されたものが多く使用されている状況になっています。これは厚生労働省の資料からもジェネリック医薬品に限られている訳ではありません。ジェネリック医薬品については、使用促進のためのロードマップに従い、幅広い情報公開が求められており、ジェネリック医薬品各社もそれにお応えする活動を続けております。
ジェネリック医薬品は同一有効成分が複数品目製造販売されていることから、ジェネリック医薬品を更に理解するためにも原薬製造国の公開が求められており、最近のロードマップ検証検討報告からも、ジェネリック医薬品のこうした情報を公開する医療関係者からの要望が多く見受けられています。
こうした要望に対して、ジェネリック医薬品の一層の信頼性を確保する観点から、日本ジェネリック製薬協会では、6月以降会員企業に対し、自主的に原薬製造国情報を各社ホームページで公開することを依頼致しました。その際、原薬製造国の定義が定まっていないことから、関係者のご助言を踏まえて、今回の原薬製造国の公開については、原薬製造国を以下のように定義致しました。
原薬製造国の定義
①製品品質を決定する最終精製工程(再結晶工程・濾過工程等)を実施した製造施設が属する国。
②輸入により粗製品原薬を国内で最終精製工程を行った原薬は、最終精製工程前の粗製品原薬の
製造国と最終精製工程を実施した国(日本)を併記する。
10月末日現在、GE薬協会員の28社が各社ホームページ上で原薬製造国の公開を行っています。(本年6月より以前に開始している2社を含む。)
【参考】
・ジェネリック医薬品への疑問に答えます
~ジェネリック医薬品Q&A~ (平成27年2月 厚生労働省)
https://www.mhlw.go.jp/file/06-Seisakujouhou-10800000-Iseikyoku/0000078998_3.pdf
・厚生労働省医政局経済課 委託事業
後発医薬品使用促進ロードマップ検証検討事業報告書
(平成30年3月 三菱UFJリサーチ&コンサルティング株式会社)
https://www.mhlw.go.jp/content/10800000/000346441.pdf



