「BE試験」
BE試験とは
BE試験とは、生物学的同等性(Bioequivalence)試験の略で、ジェネリック医薬品の開発の際、先発医薬品に対する自社開発品の治療学的な同等性を保証するために行う試験のことです。BE試験は、ジェネリック医薬品の開発だけではなく、新薬開発時においても開発中の製剤処方や剤形の変更、ライフサイクルマネジメントの一環として行われるOD錠等の剤形追加の際にも実施されています。一般的にはヒトにおける血中薬物濃度を測定することによりバイオアベイラビリティの比較を行う試験のことを指しますが、広義には、効力を裏付ける薬理作用を比較する薬力学的試験や、主要効能に対する治療効果を比較する臨床試験も含まれます。また、一定の条件の下ではヒト試験が免除されることもあります。
評価方法
BE試験では、ヒト(健康成人)に先発医薬品とジェネリック医薬品を交互に服用してもらい(クロスオーバー法)、血中濃度を測定します。経口投与された医薬品は胃で崩壊・溶出し、小腸に移行して吸収され、門脈を通って肝臓に運ばれ、代謝を受けた後に全身循環へと移行します。その血中濃度の推移は図のようになります。一般的に全身循環血の血中濃度と薬効はよく相関しますので、薬物の吸収量を表すAUC(血中濃度-時間曲線下面積)と吸収速度を表すCmax(最高血中濃度)の2つのパラメータを用いて、比較を行います。
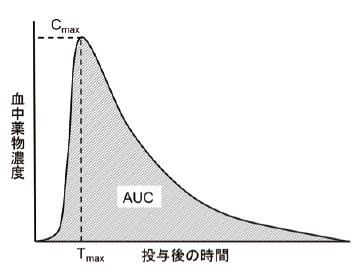
AUCやCmaxは対数正規分布することが知られていますので、それぞれを対数化し、平均値の差の90 %信頼区間が、log(0.80) ~ log(1.25)の範囲にあるとき同等と判定できます。この方法は、実施に関して細かな違いはあるものの、世界で共通して用いられています。
なお、BE試験ガイドラインは、現在改訂作業中で、2月末よりe-Govサイト(https://www.e-gov.go.jp/)でパブリックコメントの募集が始まっています。
参考
厚生労働省医薬食品局管理課. 後発医薬品の生物学的同等性試験ガイドライン等の一部改正について. 薬食審査発0229第10号 (平成24年2月29日).
厚生労働省医薬食品局管理課. 「後発医薬品の生物学的同等性試験ガイドラインに関する質疑応答集(Q&A)について」等の改正等について. 事務連絡 (平成24年2月29日).



