公知申請
医療用医薬品は、厚生労働大臣により承認された効能・効果、用法・用量(以下、効能・効果等)の範囲内で保険診療での使用が認められており、これを適応に従った使用と云われています。しかしながら、医療用医薬品を処方される医師等の先生方は、個々の患者さんによって病態が異なることから、海外での使用状況、論文等の評価や薬理作用に基づく専門的な判断により、必ずしも承認された効能・効果等ではなく必要に応じた使用が行われることがあります。こうした使用については、保発51号昭和55年9月3日付厚生省保険局長通知「保険診療における医薬品の取扱いについて」において、厚生大臣(当時)が、学術上誤った判断をせずに、必要に応じて保険診療でも使用を認めることが通知されています。医療現場において、厚生労働大臣が承認した効能・効果等以外の使用が行われることは適応外使用と称されています。
適応外使用については、その使用には十分な科学的根拠があるものがあり、医療の中でより適切に使用されるために、効能・効果等の承認を受けるべきではないかとの検討が行われており、研第4号、医薬審第104号平成11年2月1日付「適応外使用に係る医療用医薬品の取扱いについて」の通知が発出されました。この通知では、医療用医薬品の承認された効能・効果等とは異なる使用について、
・関係する学会等からその適応外使用を認める要望の提出
・専門的に、その適応外使用が医療上必要であることの評価・確認
・行政当局から、その適応外使用については厚生労働大臣の承認した効能・効果等に追加すべきであるとの要請
・関連する企業はその使用に関する効能・効果等を追加するための臨床試験等の実施や必要な検討
などが行われることになっています。
こうした検討等の後、さらに企業における検討の結果、下記の条件を満たす場合には、既に使用されている適応外使用が広く医学薬学上知られていると認められている(これを公知と称します。)として、臨床試験の全部又は一部を新たに実施することなく、同条件を満たすことを示す資料を元に適応外使用の効能・効果等については、厚生労働大臣が承認の可否を判断することが可能であるとされています。
こうした申請が公知申請になります。
(条件)
(1)日本と同等の水準と認められる承認制度を有する外国において、当該効能・効果等が承認されており、その使用が医療において相当数の使用実績があり、その外国の審査当局に提出された承認申請資料が入手できる場合
(2)外国において、当該効能・効果等が承認され、医療における相当数の使用実績があり、国際的に信頼できる学術誌に掲載された科学的根拠となり得る論文又は国際機関で評価された総説等がある場合
(3)公的な研究事業の委託研究等により実施されるなど、その実施に係る倫理性、科学性及び信頼性が確認し得る臨床試験の試験成績がある場合
現在、適応外使用に関しては、関連する学会からの要望について、厚生労働省に設置された「医療上の必要性の高い未承認薬・適応外薬検討会議」(以下、「検討会議」)において、医療上の必要性を評価するとともに、承認申請のために実施が必要な試験の妥当性や公知申請への該当性の確認などが行われ、該当する製造販売業者による未承認薬・適応外薬の開発が促されます。
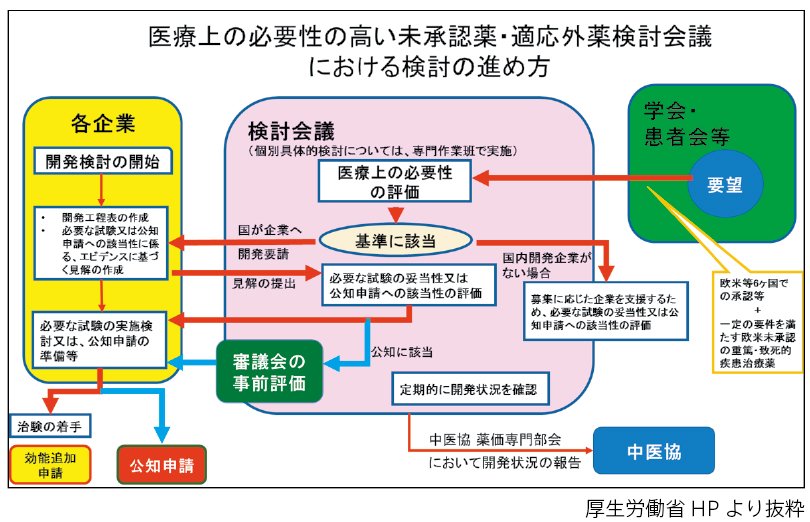
厚生労働省の「検討会議」では、関連する企業からの資料に基づき、必要な試験の妥当性や公知申請への該当性の評価が行われ、公知に該当した場合には報告書が作成されます。この報告書は厚生労働大臣の承認に係る審議が行われる薬事・食品衛生審議会(図表では「審議会」と記載)において、公知申請に関する事前評価が行われます。本評価を受けた医薬品は、厚生労働省より通知され、その通知に従って、該当する製造販売業者は効能・効果等を追加する申請を行うことになります。
本制度の実施当初は、当該通知により認められた医薬品は、成分(一般名)ではなく、先発医薬品の販売名が指定されたため、後発医薬品は対象外の取扱になっていました。
しかしながら、先発医薬品のみ公知申請で追加された効能・効果等を有することは、医療現場での混乱を招くことから、該当する後発医薬品についても「検討会議」で作成された報告書を利用した公知申請を行っても差し支えないとされ、先発医薬品と同時期に公知申請を積極的に検討するように通知されています(医政経発0223第1号、薬食審査発0223第1号平成23年2月2日付「薬事・食品衛生審議会において公知申請に関する事前評価を受けた医薬品の後発医薬品の取扱いについて」)。
なお、先発医薬品と同時期に公知申請を行わなかった場合には、先発医薬品の承認後遺漏なく迅速に、その効能・効果等を追加する申請(一変申請)を行い、効能・効果等の相違を速やかに是正する旨が通知されています(医政経発0329第1号、薬食審査発0329第4号平成24年3月29日付「後発医薬品における効能効果等に関する取扱いについて」)。
公知申請に係る事前評価が終了した医薬品については、直ちに医療現場での使用が可能となるよう、追加する効能・効果等の承認は得られていませんが、その効能・効果等については保険診療での使用が認められる取扱いになっています。しかしながら、この保険上の取扱いに関する通知には、先発医薬品の販売名、製造販売業者名のみの記載となっていることから、同時期に公知申請を行っている後発医薬品については適用されないことになります。つまり、後発医薬品は公知申請の効能・効果等の承認が得られるまでは保険診療で使用することが出来ず、先発医薬品とは明確に取扱いが異なっています。
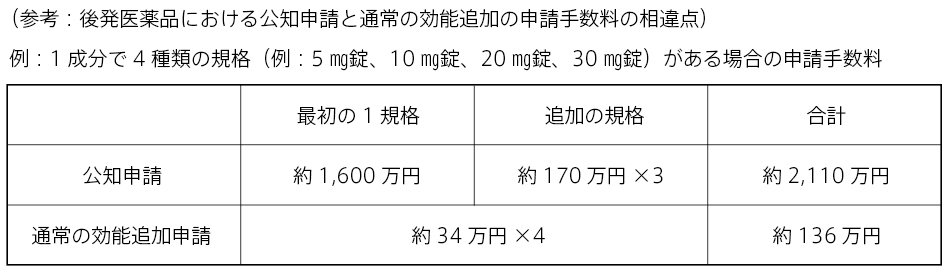
一方で、公知申請による効能・効果等の申請は、申請区分上は新効能であることから、その申請手数料は、先発医薬品、後発医薬品とも同額になっています。保険診療が可能になる時期には差がありますが、申請手数料は新薬並の高額な金額になります。
先発医薬品が公知申請により効能・効果等が承認されても、その効能・効果等は公知であることから、再審査期間は設定されません。つまり再審査期間がありませんので、後発医薬品は当該効能・効果等を追加する申請を行うことは可能になります。そのため、先発医薬品と同時期に公知申請を行わない後発医薬品については、先発医薬品の効能・効果等の追加の承認後に適宜効能・効果等の追加申請を行うことになりますが、この場合の申請手数料は既に承認されている効能・効果等のため、後発医薬品の効能・効果等の追加の取扱になることから、公知申請の手数料よりもかなり低い金額になります。また、後発医薬品の効能・効果等の追加申請の審査期間は、通常、申請後6ヵ月以内となっており、短い期間で承認されています。
先発医薬品と同時期に公知申請を行った後発医薬品については、約 6 ヵ月間のみ先行した承認取得となることになりますが、僅か6ヶ月間先行して効能・効果等の承認が得られるメリットよりも、公知申請を同時期に行う申請手数料のコストのデメリットの方が大きく、費用対効果として見合わないことが多いため、このため、多くの後発医薬品は先発医薬品と同時期に申請が行われていないのが実情です。