医薬品の再評価について
1. 医薬品の再評価とは
一度、承認された医薬品であっても、年月の経過とともに、現在よりもっと効果の高い薬、安全性の高い薬が発売され、存在価値がなくなったり、現在の評価基準では有用性が認められないことがあり得ます。再評価制度は、既に承認されている医薬品について、現時点の医学・薬学等の学問水準に照らして、品質、有効性及び安全性を確認する制度です。
【対象】
再審査が終了した医薬品を含む全ての医薬品
【目的】
医学・薬学等の学問の進歩に対応して、有効性、安全性及び品質等を見直すために実施
【確認事項】
厚生労働大臣が、薬事・食品衛生審議会の意見を聴いて医薬品等の範囲を指定して再評価を受けるべき旨を公示したときは、得られている知見に基づき、次のいずれにも該当しないことを確認する。
(1) 効能又は効果を有すると認められない
(2) 効能又は効果に比して著しく有害な作用を有することにより、医薬品として使用価値がないと認められる
(3) 医薬品として不適当なもの(性状又は品質は保健衛生上著しく不適当な場合(施行規則第39条))
2. 再評価の種類
再評価には、有効性・安全性等を再評価する薬効再評価と、品質(溶出性)を再評価する品質再評価があります。
〇第一次再評価
昭和42年9月30日以前に承認された有効成分を含む医療用医薬品を対象
〇第二次再評価
昭和42年10月1日以降昭和55年3月31日までの承認を受けた(1)新有効成分、(2)新配合、(3)新効能、新用量、新剤形、新投与経路の追加承認を受けたもの等を対象
〇新再評価
昭和63年5月末より、全ての医療用医薬品を対象
〇品質再評価
平成7年4月以前に申請された医療用医薬品の内用固形製剤について、その品質を確保するために、平成9年2月より製剤の溶出性の妥当性を評価し溶出規格を設定するための品質再評価を実施
3. 医療用医薬品再評価結果
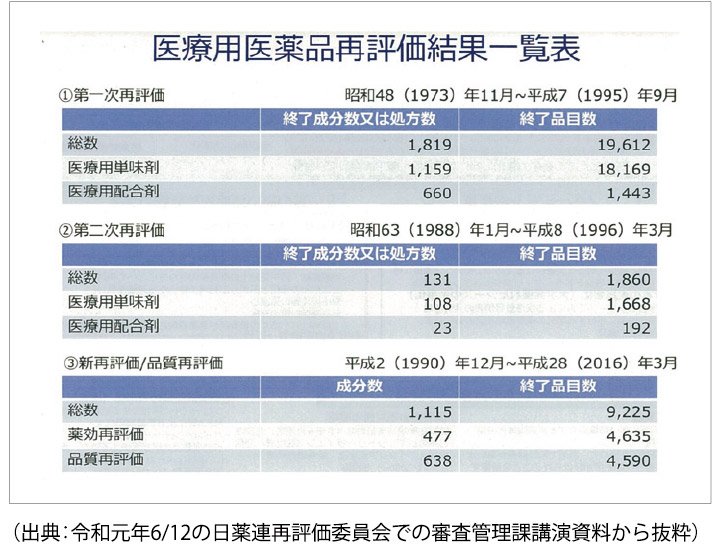
第一次再評価から品質再評価の今までの結果は、以下の表のようになっております。
第一次再評価終了品目の総数は19,612品目、第二次再評価終了品目の総数は1,860品目、新再評価の薬効再評価での平成2年12月~平成28年3月までの終了品目は4,635品目、品質再評価での平成2年12月~平成28年3月までの終了品目は4,590品目が終了しております。
4. 医薬品品質確保
平成7年以前に承認申請された医薬品は、先発医薬品、後発医薬品を問わず溶出試験は義務付けられていませんでした。医療用医薬品の内用固形製剤について、その品質を確保するため、平成10年度から溶出性が適当であるかどうか確認をするとともに、適当と認められた医薬品については、溶出試験規格を承認事項として設定するという品質再評価が開始されています。その結果は、「医療用医薬品品質情報集(日本版オレンジブック)」として、638成分、4590品目が公表されています。
その後、後発医薬品の品質に対する更なる信頼性向上を図るため、ジェネリック医薬品品質情報検討会*での検査結果等を踏まえて、有効成分毎に品質に関する情報を体系的にとりまとめた医療用医薬品最新品質情報集(通称:ブルーブック)を作成し、医療関係者向けに情報提供しております。
ブルーブックでは、有効成分毎に、品目名、効能・効果、用法・用量、薬効分類、規格単位、添加剤、解離定数、溶解度、安定性、生物学的同等性試験結果、溶出試験結果、後発医薬品品質確保対策事業検査結果、分析法などの情報が掲載されております。
*現在の名称は「ジェネリック医薬品・バイオシミラー品質情報検討会」



