特別寄稿
原薬の流通の現状と安定供給に対する日薬貿の取り組み
一般社団法人日本薬業貿易協会(通称“日薬貿”)は、原薬等の輸入業者の集まりです。最近、輸入原薬のサプライチェーンおよび安定供給が注目されておりますが、原薬の輸入には日薬貿の会員が関わっているケースも多く、この機会に原薬の流通の実情と、安定供給確保のための日薬貿の取り組みについてご説明します。
なお、本稿はジェネリック医薬品向け原薬ということではなく、原薬一般に共通する説明です。原薬の状況に先発・後発の違いはありません。
1 日薬貿の紹介
はじめに日薬貿の概要をご説明します。旧法下において輸入業者が共同で使える試験設備を持つことを目的に設立されました。現在も 2 か所の試験所を拡充して、会員外の方からも多くご利用いただいています。
創立:1963 年
会員:原薬・中間体・添加剤・化粧品原料等の輸入業者 104 社(4 月末現在)
設備:試験所 ( 東京 )、大阪試験所
※原薬等の外部試験検査機関(GMP 対応)かつ厚生労働大臣登録試験検査機関
主な活動:
(1)輸入原薬等の品質試験検査
(2)薬事関連法令等薬事情報を会員へ提供、周知
(3)外国製造業者へ日本の薬事規制情報等を提供、周知
(4)輸入原薬の安定供給等について関係団体との協議及び行政との折衝等
(5)海外の薬業団体と連携して原薬等の国際的安定供給に関する協調推進
(6)法規制、試験所運営、輸入医薬品等監視制度・関税対応、国際・広報及び組織運営等の各委員会活動
原薬の輸入に携わる会員は、輸入業務だけでなく、海外原薬メーカーの日本窓口として薬事対応業務も行っています。製造業許可に相当する「外国製造業者認定」の取得代行や、原薬の製造方法等の詳細を登録する「原薬等登録原簿(MF)」に関する業務(国内管理人業務)等です。
なお、輸入業務を業として行う会員は、「医薬品製造業許可(包装・表示・保管区分)」を取得しています。本来業務としてはいわゆる商社なのですが、免許は製造業です。製造業といっても実際に製造、加工をするわけではなく、表示(原薬の外装に日本語ラベルを貼付する)と保管という行為が製造業にあたります。業許可取得にあたり、構造設備や文書(手順書、記録類)が GMP に適合しているか規制当局(都道府県)に実地で確認されます。
2 原薬の品質確保
原薬の製造方法や製造業者 ( メーカー ) がどう管理されているのか、図 1 に全体像を示しました。ポイントは、製造販売業者が承認書に記載された全ての製造所を管理するということです。製造販売業者と各製造所は品質取り決め(GQP 契約)を締結し、製造販売業者は定期的な監査によって管理状況を確認しています。
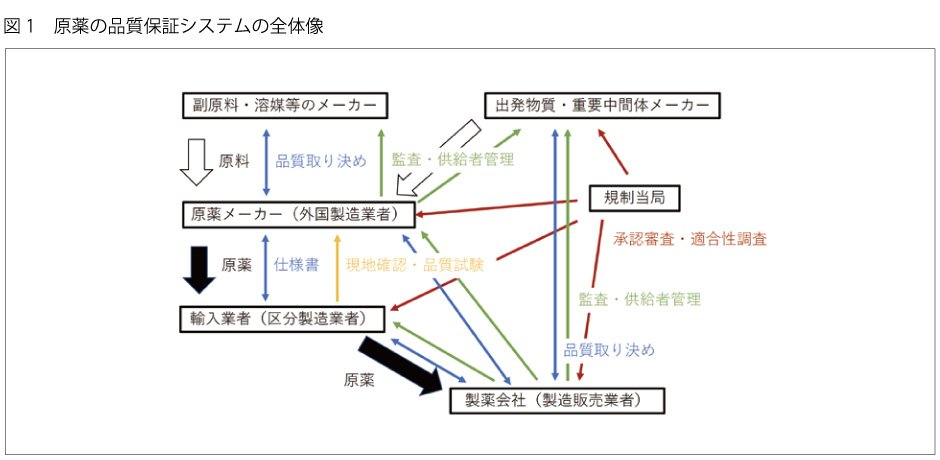
もちろん、輸入業者も原薬メーカーの現地確認を何回も実施し、品質や製造方法を契約しています。
規制当局の承認審査では、不純物の少ない原薬を安定して製造できる製造方法が確立されているかどうかを中心に厳しく審査されます。原薬メーカーは、不純物がどこから来てどう除去しているのか、理論とデータで説明しなければなりません。
承認前に GMP 適合性調査も実施され、製造所の製造管理・品質管理が確認されます。製造所でクオリティカルチャー(経営陣から現場までの、会社の品質に対する意識)が醸成されていることが一番重要です。原薬メーカーが作っているのは有効成分ですが、当然、最終的に患者さんの体内に入るものだという意識を持って仕事をするべきです。
日本で使われている原薬は、全て承認審査と GMP 適合性調査をパスしているわけで、どこの会社が作ったものであろうが日本が要求する水準をクリアしていることは保証されています。品質に関しては、どこの国で作ったのかよりも、誰がどう作ったのかということこそ重要なのです。
3 原薬の流通(輸入)
原薬の多くは粉末の状態で、物性、品質特性、安定性によって包装と輸送条件が決められています。
包装も輸送条件も、製造販売業者と原薬メーカーが取り決めを結んでいます。
(1) 原薬の包装
物質の特性(例えば吸湿性や熱や光に対する安定性)により適切な包装形態、保管および輸送条件を決めています。吸湿により粉末が凝集したり、酸素・熱・光等により分解して不純物が増加したりすることを防ぐためです。
包装形態は、図 2 の例のように多様であり、原薬の特性によって最適なものが選ばれます。安定した原薬であればファイバードラムもしくはポリドラムという形が一般的です。中身は、外部からの異物混入を防ぐために PE の内袋を二重とし、それぞれインシュロックで縛っています。その他、密封や遮光のために金属製容器としたり、空気を遮断するために内袋をアルミパウチにしたりするなど、工夫されています。どの容器も、万一輸送中に開封された場合に痕跡が残るよう封緘をしたり、あるいはボトル形式の場合はキャップを開けたら元に戻せないようにしたりといった工夫がされています。
原薬を変化させない、異物を混入させない、開封されない/されたら痕が残る、外部からの物理的ダメージから守る、といった観点から包装が決められているわけです。

(2) 原薬の輸送
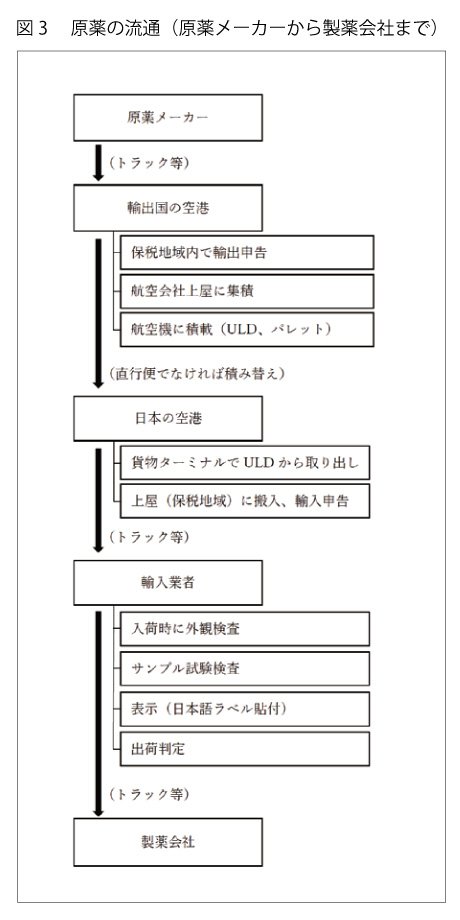
原薬メーカーを出荷してから日本に来るまで、図3の空輸の例のように多くの人の手を経ています。
原薬メーカーから現地の空港まではトラック等で内陸輸送です。通常、原薬メーカーは「フォワーダー」と呼ばれる業者(国際輸送に関わる諸々の手配をしてくれます。「乙仲」「通関業者」もほぼ同義語)に輸出の手配を依頼します。フォワーダーは輸出の航空便を手配し、それに合わせて原薬メーカーから集配するトラックも手配してくれます。空港到着後、通関まではフォワーダーが手配して、その後、航空会社に引き渡され飛行機に搭載されます。搭載する貨物は、ULD(UnitLoadDevices/航空機搭載用の機器で、空港で見かける逆台形のコンテナです)に入れられるか大きな金属パレットに載せられて搬入されます。
航空便は、中国・韓国からであれば直行便となりますが、それ以外は途中のハブ空港で積み替えとなるケースが殆どです。
日本に着いてからは、保税地域で輸入申告を済ませてから外部に運び出します。通関と輸入業者へのトラック輸送は、輸入業者が乙仲(通関業者)に依頼して手配してもらいます。
海外からの輸送は、原薬の場合、船舶による海上輸送ではなく貨物機・旅客機による空輸が大半です。例えば原薬が1kgあれば100mg錠を1万錠、100kgなら百万錠製造できるわけですから、一般的に1回あたりの輸送は数十kgから数百kgです。従って、輸送時間の短い空輸の方が適していると言えます(10トン単位の貨物であれば、コンテナをチャーターできるので船という選択肢もでてきます)。なお、貨物というと貨物機で運ぶイメージがありますが、旅客機でも機体の下半分には貨物を40~70tほど積載できますので、旅客機で輸送されるケースが実は多いのです。
もちろん、中国・韓国であれば航海日数も短いので海運という選択肢はあります。海運の場合は必ずコンテナに入れられるわけですが、少量の貨物であればスペースが余って割高になりますし、かといって他の貨物と同じコンテナに混載というのも避けたいので、トン単位のまとまった数量でないと使いにくいという事情があります。一方で、コンテナをチャーターできれば、原薬メーカー出荷時に積んだコンテナのまま日本の輸入業者のもとまで運ばれてきますので(陸上輸送はトレーラー)、紛失・積み替え時の破損といったリスクが低下するメリットはあります。
(3) 輸入業者による確認
輸入業者は「製造業者(包装・表示・保管区分)」ですから、GMP に則って以下の業務を行います。
・外観検査(包装形態、外装ダメージ・汚れ、ラベル、封緘)
・ロット毎の品質確認試験(自社又は日本薬業貿易協会等外部試験機関)
・外観検査結果、品質確認試験結果、製品標準書と品質取り決め内容を確認して出荷判定
・外観検査、品質確認試験結果で問題があった場合は原薬メーカーに原因究明を依頼
包装形態やラベル、数量の間違いがあれば原薬メーカーのミスとなりますが、外装ダメージ・汚れ、封緘がないとか切れているといった不具合は、原因究明が必要となります。外装の汚れで輸送途中での取り扱い(乱雑に取り扱われていた、一時保管の環境が悪い等)が分かります。封緘がないとか切れていたら、原薬メーカー出荷後に開封されていないことが保証できません。外装をフォークリフトで刺されたりしてドラムがへこむようなダメージがあれば、中身に影響が及んでいるか確認が必要となります。
中身の原薬に影響がある場合は製薬会社に納品せず海外に返品しますので、輸入業者は不良品が国内流通するのを防ぐという役割も負っていると考えています。
なお、輸入業者は、輸入の都度に行う品質確認業務だけでなく、その後も継続的に以下のような業務を行っています。
・原薬の安定性モニタリングにより不純物の動きを確認
・輸入業者での不適判定や製造販売業者から不適等のクレーム連絡があった場合の原因究明と対策
・製薬会社の監査によるフィードバック(指摘・推奨事項)や年次照査等から原薬メーカーでの CAPA実施(是正措置・予防措置をとってもらう)
・継続的な情報収集(製造と物流に関する海外の法規制、原薬メーカー自身や同じ品目に関連する学術発表、他国での Warning Letter や健康被害情報の有無)
・原薬メーカーと共に不純物を減らすための製法や分析法の開発や中間体の調査
・原薬の製造方法や製造設備に変更がないことの定期的な確認
(4) 輸入原薬特有の事項
輸入原薬には、海外の原薬メーカーと物理的に距離があるという以外に、海外のビジネス慣習あるいはお国事情といったものがあります。
原薬メーカーは他種の製造業と同じく、年間の製造計画や中間体購入計画を立てて原薬を製造しています。また、同じ原薬を日本以外に販売しているケースも多く、1 年間に世界中に売る分を何回かに分けて製造することが通常です(キャンペーン生産といい、例えば 1 回 5 ロット製造し、それを四半期毎に年 4 回など)。これは、ある 1 つの原薬だけを製造する専用ラインではなく、複数品目を製造する原薬メーカーが多いためです。欧米の原薬メーカーでは、通常、顧客と供給契約を結び、次年度の購入計画を購入側に示してもらい、年間製造計画に組み入れて、6ヶ月以上のリードタイムを持って製造します。
お国事情ということでは、まず祝祭日には気を付ける必要があります。日本のお盆のように、製造および物流が止まる期間があります。祝祭日等の前後を含めた期間は、前もって輸入しておくなど、製造依頼も出荷も避けるようにしています。中国・韓国の旧正月、韓国の秋夕(お盆休みのようなもの)、欧州の夏休みとクリスマス、イスラム圏のラマダン等、スケジュールは前もって分かるので注意しています。
祝祭日以外も注意すべきものが色々あります。オリンピックや万博等の国家的イベントがある場合は、大気汚染対策で工場の操業が止められたり、渋滞対策で物流が制限されたりする可能性があります。GMP や流通に関する法規制が変更されることもあります。予期せぬ事件事故もあり、多数の死傷者が出る大規模な爆発事故等の場合は、広範囲に影響が出ます。また、一番極端なケースでは貿易戦争で輸出入が制限されるということもあり得ますが、そこまで至らなくとも、国家間の緊張が高まるだけでも輸入がしにくくなることがあります。
このため、日々の情報収集は欠かせません。大きなニュースは、自分が扱っている原薬のサプライチェーンに直接・間接に影響があると考えなければなりません。国産原薬でも、原料(出発物質や中間体)が輸入品であれば、同じように影響を受けます。
4 日薬貿の取り組み
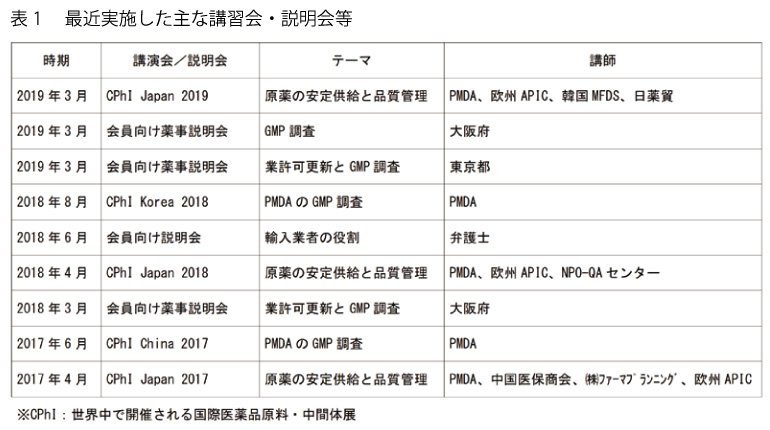
原薬の品質と安定供給は、製剤の品質と安定供給に直結しています。輸入原薬の品質確保と安定供給確保のためには、会員企業のレベルアップと、業界としての対応の両方が必要です。このため日薬貿では法規委員会での活動や表 1 の講習会・説明会等を行っています。
品質確保のために、薬事関連法令等薬事情報を会員へ提供し講習会等で周知しています。海外原薬メーカー向けには、英訳した日本の薬事規制情報等を提供するほか現地での講演会等により周知しています。安定供給のために、国内の関係団体との協議及び行政との折衝等を行い、海外の薬業団体と連携して原薬等の国際的安定供給に関する情報交換や講演をしています。
法規委員会では、法規制変更内容の周知や対応策検討(個々の失敗事例も可能な範囲で情報共有)、海外への周知、情報提供と国際整合性の提案、カントリーリスク情報の共有等、色々な活動を行っています。
日本の法規制を海外に知ってもらう、あるいは国際整合を推進する、といった活動は、安定供給にも関係しています。例えば、変更管理は国によって細かいルールが違いますので、日本の制度の理解が不十分なために間違った対応をして承認書と実際の製造方法に相違が生じることもありますし、世界中に同じ原薬を供給する海外メ-カ-としては、国ごとのルールが同じであるほうが間違いを減らせるのです。
5 新型コロナウイルス感染拡大防止策の影響と今後の課題
各国のロックダウンと渡航禁止により、原薬の輸送と製造が大きな影響を受けています。
最初に影響が出たのが輸送です。前述のように、原薬がメーカーから日本に届くまでの間、多くの人が関わっています。フォワーダー、トラックドライバー、空港職員、税関職員、航空会社職員等ですが、どこが欠けてもスムースに原薬が運べません。ロックダウンにより全ての職場で出勤者が減り、業務量が大幅に減りました(つまり荷物がどんどん滞留)。現地国内のトラックでの輸送も、必需品ということで移動は出来ますが、検問で時間が余計にかかります。旅客便が飛ばなくなったため、旅客機で輸送していた貨物の輸送力が丸々なくなりました。このため、原薬が現地にあるのに日本に運べない、といった事態になりましたし、運搬スペースの取り合いで空輸運賃や貨物取扱手数料が高騰しました(「コロナ・サーチャージ」が加算されたわけです)。
原薬の製造にもこれから影響が出てくると考えられます。どこの国でも、医薬関連はロックダウン下も活動は許されていますが、従業員が全て出てこられるわけではないので稼働率は低下します。また、原薬の製造に必要な原料(出発原料、中間体、副原料等)や資材(内袋、外装、インシュロック、ラベル等)あるいは溶媒が 1 つでも欠けると製造ができません。ヨーロッパやインド、韓国等の原薬メーカーは、出発物質や中間体を中国等から輸入するケースも多く、輸出入が制限されている状況では入手難が続きます。
また、インドが一時期、医薬品の輸出制限をかけました。国が自国民を最優先する動きをするのはやむを得ないことですが、もしすぐに緩和されていなかったら、対象品目は世界中で取り合いになっていたでしょう。
今後さらに製造業国内回帰の動きが加速し、特に国をまたぐサプライチェーンは見直されることになると思いますが、原薬については、中間体・出発物質といった上流工程をどこまで国産化できるかがネックになるのではないでしょうか。化学合成や発酵で作られる原薬は、一般的に上流に行くほど汎用性の高い化学品ですので、大量に安く作れる会社に集約する傾向があります。国産化できるものはその方が安心ですが、原薬は品目が多いので、もう少し広く、例えば東南アジアに分散したサプライチェーンを構築するという考え方をしても良いと思います。
日本製薬団体連合会が「医療用医薬品供給調整スキーム」を策定し、幅広く関係者と連携しながらチームで供給調整にあたるという仕組みができたことは素晴らしいと感じています。日薬貿としても会員会社が原薬を安定供給できるよう活動していきますが、この機会に原薬の実情についてより多くの方に知っていただき、皆さまからのご協力をいただければ幸いです。
鹿児島県における後発医薬品安心使用促進事業について
1 鹿児島県におけるジェネリック医薬品使用状況について
鹿児島県におけるジェネリック医薬品の使用状況は、令和元年 10 月現在の「最近の調剤医療費(電算処理分)の動向」におけるジェネリック医薬品割合において、84.8%(数量ベース)であり、平成 29 年 6 月 9 日に閣議決定された「経済財政運営と改革の基本方針 2017」で国が掲げた「2020 年 9 月までに、後発医薬品の使用割合を 80%とする」目標を既に達成しています。その一方で県内でもジェネリック医薬品使用割合には地域較差がある等の課題もあります。
2 鹿児島県のこれまでの取組について
鹿児島県においては、平成 20 年 10 月に医療関係者、保険者、学識経験者等で構成する「鹿児島県後発医薬品安心使用協議会(以下、「県協議会」という。)」を設立し、ジェネリック医薬品の安心使用に係る環境整備に向け、継続して取り組んでいるところです。
平成 23 年度は、加世田保健所地区をモデル地区とし、地域での研修会の実施等、重点的にジェネリック医薬品の安心使用に係る環境整備を図るモデル事業を実施しました。
平成 25 年度は、新たな地区協議会の場として、鹿屋保健所地区を選出し、医療関係者を対象者としたアンケートや医療関係者や住民向けの研修会を実施しました。
平成 27 年度以降は、各地域で医療関係者向けのシンポジウムを開催しました。
県協議会を中心にこれまで取り組んできた取組の詳細は次のとおりです。
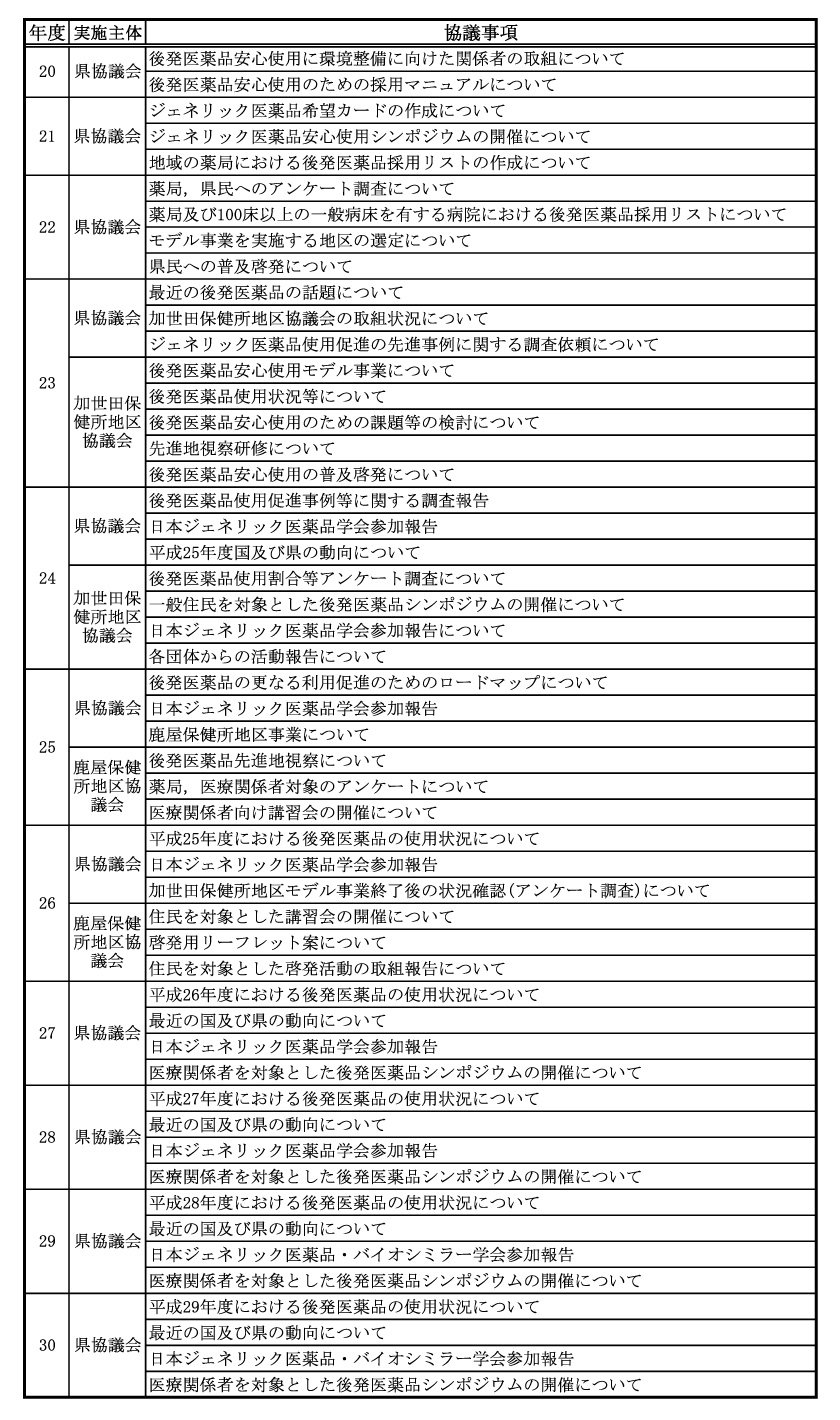
3 令和元年度の事業について
令和元年度については、主に以下の内容に取り組みました。
⑴ 後発医薬品安心使用促進講習会
医療従事者を対象とした講習会(講演内容は「後発医薬品使用促進のためのジェネリック業界の取組」、「協会けんぽの取組について」、「後発医薬品を推進するためのフォーミュラリーについて」)を開催しました。また、Web 会議システムを利用し、奄美大島にある県立大島病院にも配信しました。
⑵ リーフレットによる普及啓発
令和元年度においても、県民向けのリーフレット 30,000 部を作成し、県内の薬局約 900 店舗に配布しました。
4 今後の取組について
今後も県協議会を中心に、ジェネリック医薬品使用割合が低い地域において、講習会等を実施する等、ジェネリック医薬品を安心して使用できるよう環境整備に努めていきたいと考えております。