沢井製薬株式会社

沢井製薬株式会社
https://www.sawai.co.jp/company/profile/info/
創 業 年 :1929年4月1日
代 表 者 名:代表取締役社長 木村 元彦
本社所在地:〒532-0003 大阪市淀川区宮原5丁目2-30
従 業 員 数:2,592名(2023年3月31日現在)
【企業理念】
なによりも患者さんのために
1.「真心をこめた医薬品を通じ、人々の健やかな暮らしを実現する」それがsawaiの使命です。
2.「創造性を追求し、革新と協調により社会と共に成長する」それがsawaiの挑戦です。
3.「お役に立ちたいという心を持ち、なくてはならない存在になる」それがsawaiの願いです。
Biorelevant dissolution
安定供給は最大の課題であることは勿論ですが、新製品の創出は企業存続、成長の源泉です。新薬の中でも主なものは低分子化合物で、近年開発対象品目数が漸減傾向といわれていますが、依然としてジェネリック医薬品の低分子化合物が開発の主要な対象となっております。しかし、コンビナトリアル化学やハイスループットスクリーニング、タンパク質立体構造に基づく分子設計等の検討が進み、候補化合物の分子量増大と共に脂溶性も増して、難水溶性化合物の数が年々増加してきていることは広く認識されています1)。 近年、難溶性化合物の増加に応じて様々な製剤化技術が開発されてきており、特に固体分散体、アモルファス、マイクロエマルジョン、ナノ粒子等の新たな製剤技術で多くの医薬品が創製されてきており、これらの技術を用いて開発された製剤は食事の影響を受けることも多く、当局からも生物学的同等性ガイドラインの改正が行われることになりました2)。
ジェネリック医薬品開発において評価条件が増加することは開発難度が高まることにも繋がり、また、開発コストも上昇することになる一方で、BE試験と処方検討を繰り返し行うことは、限られた社内資源を効率的に使うためにも倫理的にも最小限にすべきです。その為に in vitro 評価系の検討をより一層充実させていく必要があります。特に経口製剤開発で重要な役割を担う評価法としてヒト消化管環境を模倣した溶出試験液・試験条件(Biorelevant dissolution test)が活発に検討されています。
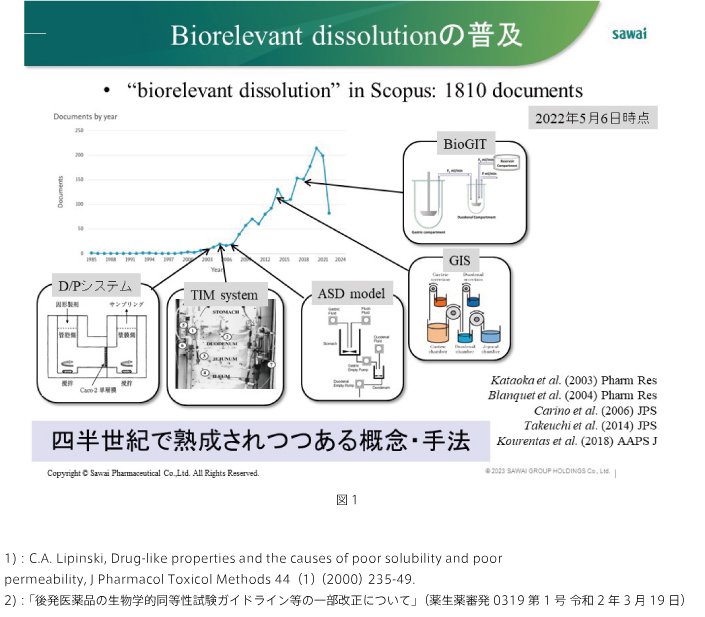
2022年のSCOPUSの調査によればBiorelevant dissolution testに関連した論文が合計1810報出され、2000年以降に急激に増加しています。その間に様々なモデルが提唱・開発されてきました(図1)。しかし、単一の試験法で全経口医薬品の挙動を予測することは困難であり、薬物特性・製剤特性に応じて適切なBiorelevant dissolution testを選択することが不可欠です。
弊 社 で も 幾 つ か のBiorelevant dissolution method(USP apparatus ⅢやFlow through cell 等も含めて)を導入或いは開発し、多くの製品開発に利用してきました。最近は個別データの普遍的な利用に進んでいないことに気づき、BE適合難易度が高かった開発品目や製剤開発に資した手法などを特徴付け(タグ付け)し一元管理することで、新規の開発品目に有用な情報が誰でも引き出せるBE評価管理システムを構築しています。これにより、過去の開発品目で実施した製剤/主薬の特徴、Biorelevant dissolution method を含めたin vitro 及 び in vivo試 験の概要等を確認でき、新規開発品目において、類似開発品目の実施例から最適なBE予測評価手法を抽出・実施できる体制を整え、一層効率的な製品開発を進めています。