オレンジレターについて
医薬品、医薬部外品、又は厚生労働大臣が指定する成分を含有する化粧品は、その製造管理又は品質管理の方法が厚生労働省令で定める基準に適合した製造所で製造することが、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、薬機法)で求められています。
ここでいう厚生労働省令で定める基準とは、「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」(GMP省令と称されています)を指します。
国内で製造販売する医薬品等の製造販売承認を受けようとするときや、承認された事項の一部変更に係る承認を受けようとするとき、輸出用医薬品等の製造を行おうとするときには、原則として、承認もし
くは一部変更承認を受けようとする品目又は製造しようとする品目について、製造所ごとに調査が行われます。また、承認取得後においても一定の期間毎に調査が行われます。
この調査(GMP調査と称されています)には、現地(製造所)で直接行う調査(実地調査)又は書面による調査があります。
GMP調査により確認された指摘事項(調査により疑問点や改善・見直しなどが必要と考えられる事項)等については、従来は、調査対象とした製造所にのみ交付されていましたが、令和4年4月より、医薬品製造業者等に対するGMPの理解・普及を目的として、独立行政法人 医薬品医療機器総合機構(以下PMDAという)が実施したGMP調査の指摘事項のうち、医薬品業界への周知が特に有用と考えられる事
例について、注意喚起や技術的な参考として公表されることとなりました。
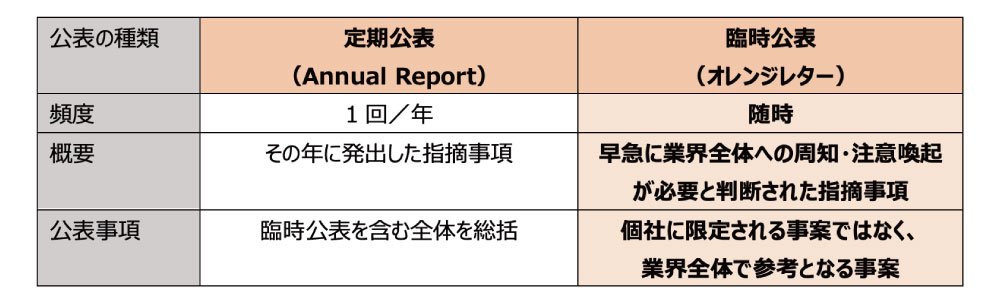
このGMP調査の指摘事項に関する公表には、1年に1回の「定期公表」と随時行われる「臨時公表(オレンジレター)」があり、組織的な不正が認められたものや、品質への影響が高いもの等、早急に業界全体への周知・注意喚起が必要と判断されたものがオレンジレターの対象となっています。
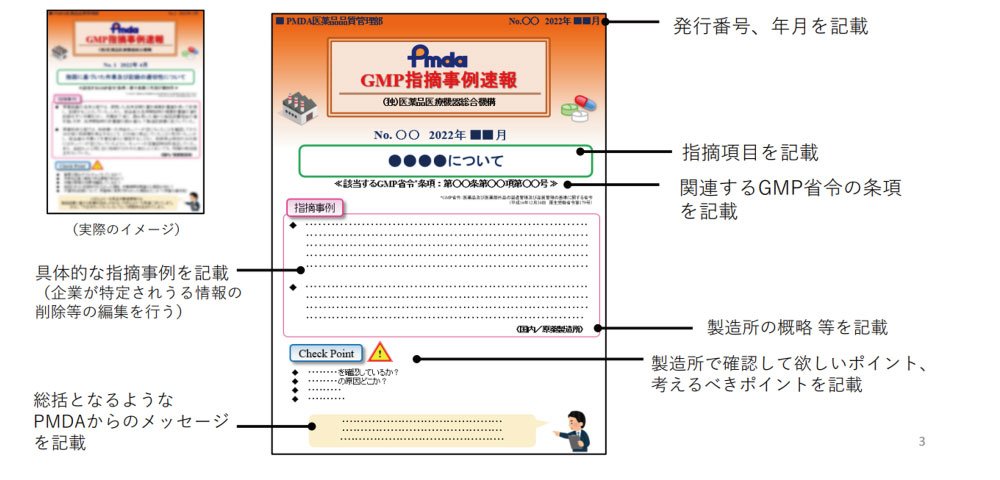
オレンジレターでは、「指摘事項の具体的な内容(背景・確認された事例・問題点・リスク)」、「製造所で確認してほしいポイント、考えるべきポイント」、「関連するGMP省令の条項」及び「PMDAからのメッセージ」が1枚に記載されており、各製造所における品質向上のための自主的な改善、製造販売業者による委託先への管理監督の強化及びPMDAによる調査業務の透明性・予見可能性の向上が大きな目的の一つとなっています。
2023年10月までに、オレンジレターはNo.11まで公表されており、これらはPMDAのホームページにてご覧いただくことができます。
【GMP 指摘事例速報(オレンジレター)一覧】
品質確保に関する取り組み | 独立行政法人 医薬品医療機器総合機構(pmda.go.jp)
日本ジェネリック製薬協会では、会員企業各社の製造管理、品質管理に活用してもらうために、このオレンジレターを会員企業に周知しています。オレンジレターでの他社の指摘事項の共有は、各社の製造管
理、品質管理体制を見直す格好の機会であり、各社の堅牢な製造管理、品質管理体制の構築に役立っています。



