ジェネリック医薬品の電子化された添付文書(電子添文)の新記載要領への改訂と真の情報充実に向けて
医療用医薬品の電子化された添付文書(以下、「電子添文」と称します。)の記載要領が、2017年6月に約20年ぶりに改正されました。改正内容の詳細についてはJGA News 2019年5月号(No.133)「知っ得!豆知識」に掲載していますが、今回の改正においてジェネリック医薬品にとって一番のトピックは、医療関係者が医療用医薬品を使用される際に重要な情報原となる「使用上の注意」、「取扱い上の注意」を先発医薬品と原則、同一記載とすることです。従来のジェネリック医薬品の電子添文の「使用上の注意」には、副作用の発現頻度が記載されていないなど、医療関係者の目線からすると十分な情報が記載されていないという状況でした。

また、電子添文の記載要領の改正に係る通知発出後の2018年4月には「後発医薬品の添付文書等における情報提供の充実について」(以下、情報提供充実通知とします)という通知が発出されました。この通知では、先発医薬品と同一記載の対象外となっていますジェネリック医薬品電子添文の「薬物動態」、「臨床成績」、「薬効薬理」(以下、「薬物動態等」と称します。)の各項に関する情報提供の充実を目的として、これらの項に記載する情報については、公表されている情報(学術文献、先発医薬品の申請資料概要、審査報告書等)に基づき先発医薬品と同等の情報提供(以下、「同等記載」と称します。)を行うこと、という新しい対応が求められるものでした。従来のジェネリック医薬品の電子添文の「薬物動態等」には、先発医薬品との同等性を確認した生物学的同等性試験概要や基本的な薬理作用の記載程度でしたが、記載要領改正と情報提供充実通知の発出により、ジェネリック医薬品の電子添文における、更なる情報充実が大いに期待されることになりました。
新記載要領への改訂と情報の充実については、通知が発出された時期からも、ジェネリック医薬品の各企業は、この2つは同時に対応することが求められているものと考えていました。そのため「使用上の注意」、「取扱い上の注意」の新記載要領改訂を行いつつ、「薬物動態等」の情報充実のための情報収集や記載内容の検討を同時並行で行っていました。しかし、「薬物動態等」の各項の情報充実は検討を進めるに従い様々な問題点があることが判明し、難航を極めました。この問題点の詳細についてはJGA News 2020年6月号(No.146)「知っ得!豆知識」、以下に記載致しました「情報入手上の課題」と「記載内容上の課題」、この2つが大きな問題の障壁として立ちはだかったことが原因です。

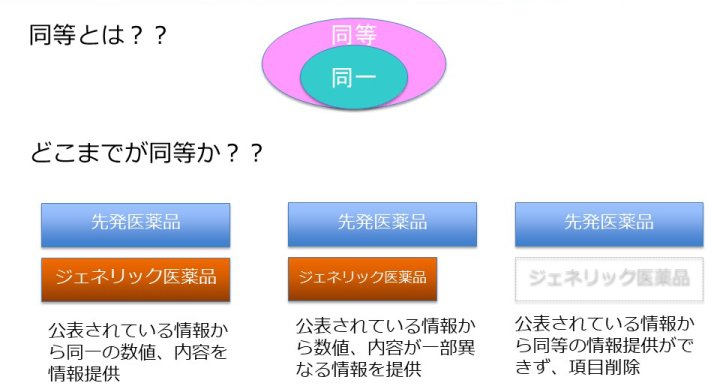
また、2つの壁に加えて、2018年4月の情報充実通知に記載された「同等」の解釈とその定義が大きな問題となり、各社の電子添文担当者を大いに悩ませる事案となりました。
これは例えば、先発医薬品の電子添文に有効率80%と記載されている場合、「同一」であれば、ジェネリック医薬品の電子添文も有効率80%と記載することになりますが、情報提供充実通知では先発医薬品の添付文書に記載されている情報ではなく、公表されている情報を基に記載することが求められています。そのため、まずジェネリック医薬品企業は、資料の収集と、収集された公表資料の内容精査と確認を行います。公表資料に有効率80%との記載があれば、先発医薬品と同じく有効率80%と同一の記載を行うことが出来ます。しかし、公表資料には有効率75%と記載されている場合には、先発医薬品の80%と75%の差異があり、この5%の差をどのように判断すれば良いのか、同等の情報とみなして良いのか否か、極めて難しい問題になります。こうした場合にどのように判断するのかについては、情報提供充実通知やそれに関連するQ&Aの通知についても記載されていませんので、その結果、企業の間でもこの情報の取扱いについては次のような解釈が生じることが分かりました。
✓公表資料に従い、有効率75%と記載する
✓有効率の数値が異なるため、文章の記載で「有効性が認められた」との記載とする
✓有効率の数値が異なるため、当該項に関する有効性に関する情報の記載内容を削除する
この問題は、同一有効成分である先発医薬品とジェネリック医薬品の電子添文の情報が異なることに加え、同一有効成分のジェネリック医薬品の間でも異なる情報が記載される可能性があるという問題に派生しています。
より服用し易い錠剤とするような製剤学的な工夫についての検討・研究等を各ジェネリック医薬品企業が切磋琢磨することは、日本の製薬産業にとって、あるいは医療従事者の皆様にとって、更にはその医薬品を服用される患者さんにとって非常に良いことであると考えます。しかし、生物学的同等性試験(BE試験)等で先発医薬品との同等性が確認されている医療用医薬品の「薬物動態等」の情報が、先発医薬品とジェネリック医薬品、ジェネリック医薬品間で異なることは、患者さんのために必要な医療用医薬品を使用される医療従事者の皆様にとって、そして患者さんにとっては、医療用医薬品の製造企業としても、決して好ましい状態ではないと考えます。
こうした問題を踏まえて、日本ジェネリック製薬協会の安全性委員会では委員会内に電子添文検討部会(旧名称:添付文書ワーキンググループ)を新設し、ジェネリック医薬品の新記載要領電子添文の「薬物動態等」の同等記載における基本的な考え方を検討するとともに、各成分のジェネリック医薬品の「薬物動態等」の同等記載案の協同作業による作成・検討、当該検討における諸問題の解決のための行政当局との折衝、学会等での発表の機会を捉え医療関係者の皆様に対するジェネリック医薬品の新記載要領改訂に関する課題を周知すると共に、その問題を提起するような活動を行って参りました。しかし、新記載要領局長通知(以下、「局長通知」と称します。)で定められた、新記載要領への改訂の経過措置期間(2024年3月31日期限)が刻一刻と迫り、緊急的な対応が必要になっていきました。
「局長通知」で定められた移行期限を遵守するためは、新記載要領への改訂と情報充実を分離して考えるという折衷案を検討せざるを得ないこととなりました。当協会としては2つの対応が行えないことを非常に残念に、また悔しい思いでしたが、局長通知で定められた期限を遵守することは、ジェネリック医薬品企業として責任のある必要な対応であることから、新記載要領への改訂と情報充実を分けて考えるこの折衷案を受け入れることと致しました。すなわち、まず期限が限られている新記載要領への改訂を期限内に実施完了し、その後に継続して情報充実を行うという対応と致しました。この活動においては、安全性委員会電子添文検討部会のリーダーシップ、そして何よりも各会員企業の電子添文管理部門の尽力により、経過措置期間である2024年3月31日までに、当協会会員企業の全ての電子添文を100%新記載要領に改訂することができました。
こうして、当協会会員企業の全ての新記載要領電子添文への改訂は完了しました。しかし、「薬物動態等」の情報充実はこれから対応する課題になっています。そのため引続き、安全性委員会電子添文検討部会では、各成分の「薬物動態等」の同等記載案の作成・検討を継続すると共に、同一成分の電子添文で「薬物動態等」の項の記載内容のバラつきを可能な限り解消し、より質の高い「薬物動態等」の情報充実を進める活動を行うことを本年度の事業として計画しています。最近、某医薬品において、先発医薬品が製造販売を中止し、医薬品医療機器総合機構(PMDA)ホームページから電子添文の掲載が削除されてしまいました。ジェネリック医薬品の電子添文では、「薬物動態等」の記載が同等記載に留まっている製剤もあり、先発医薬品に記載されていた情報と同一ではないため、その情報が電子添文から消失してしまうような事例もありました。医療用医薬品の適正使用のためにも重要な情報である「薬物動態等」の情報については、より充実されるという電子添文の本来あるべき姿にすることを理念として、引き続き行政当局との折衝、医療関係者の皆様への問題提起を行い、活動を継続することとしています。
参考情報:
1)添付文書新記載要領について ~ジェネリック医薬品特有の変更点と課題について~
2)JGAニュースNo.133
3)医療用医薬品添付文書新記載要領 説明資料
4)ジェネリック医薬品添付文書記載要領 説明資料
5)「ジェネリック医薬品の電子化された添付文書作成の考え方 -主に16.薬物動態、17.臨床成績、18.薬効薬理について- 2023年3月 第1版」



