後発医薬品の全規格揃えについて
平成20年度以降に薬価基準への収載を希望する後発医薬品については、その承認に当たって標準製剤となった先発医薬品(以下「標準先発品」という。)が有する規格を、全て揃えて薬価基準収載することが求められており、標準先発品が有する規格で、医療上必ずしも必要でないと考える規格がある場合には、製薬企業の報告に基づき個別に判断することとされています。このように、後発医薬品については、その収載に当たり必要な規格がすべて揃っていることを原則とする「全規格揃え」が通知1)により求められています。
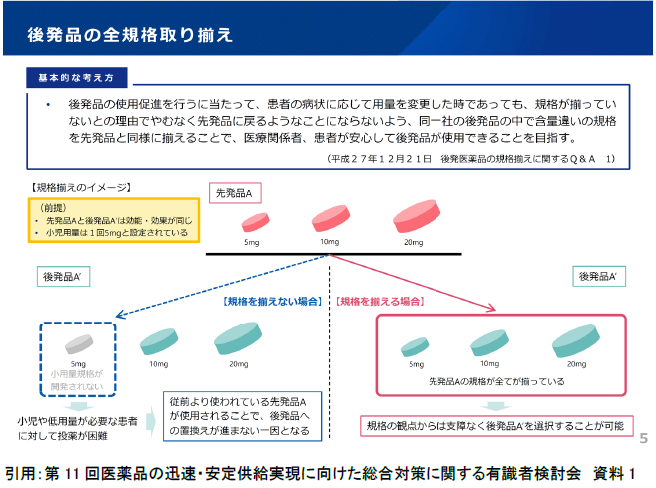
また、後発医薬品の規格揃えに関するQ&A2)が発出されており、下記に一部を紹介します。


このような規格揃えの原則については、需要の少ない規格(非汎用規格)もあるが、製造技術上少量の生産が困難であることから、一定の廃棄数量分を含んだ製造がなされており、赤字品目となっている製品があります。そのため、令和6年5月22日に取りまとめられた「後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会」の報告書3)には、少量多品目生産の適正化等生産効率の向上のための方策として以下のような提言がなされています。
●後発医薬品の薬価収載時は全規格を取り揃えることを原則としつつ、安定供給が求められる収載後5年間を経過した後は、医療現場での使用状況を踏まえ、医療上の必要性等に照らして全規格を取り揃えることが必ずしも必要ではないと考えられる品目について、一部の規格のみであっても供給停止・薬価削除プロセスを適用できるようにすることを「医療用医薬品の安定確保策に関する関係者会議」等において検討すべきである。
●また、薬価収載後5年を待たず、薬価収載時に医療上必ずしも必要でないと考える規格がある場合の取扱いを明確化することも検討すべきである。
●なお、全規格を取り揃える企業とそうでない企業が出てくることから、企業ごとに有利不利が生じないよう配慮が必要であるとともに、規格が揃わないことにより医療現場での調剤に影響が生じないようにすべきである。
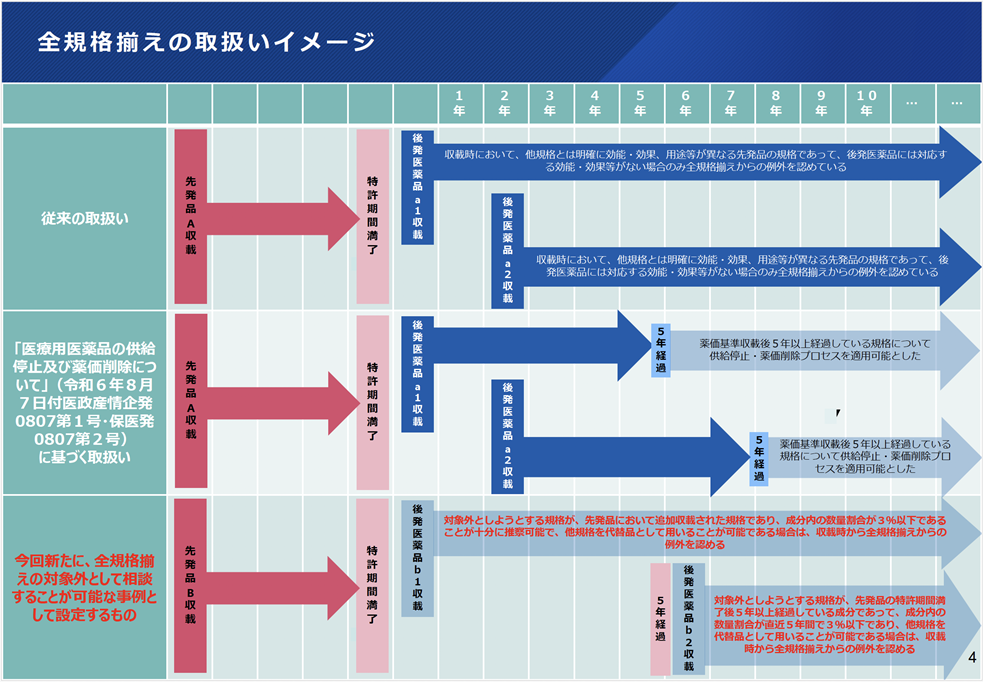
薬価削除プロセスに関しては、令和6年8月7日に「医療用医薬品の供給停止及び薬価削除について」として薬価削除手続きの明確化および、徹底条件下での簡素化が示されました。4)
「後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会」での協議を踏まえ、「医療用医薬品の安定確保策に関する関係者会議」にて議論が進められ、運用基準案が示されました。薬価削除については、当該後発医薬品の薬価収載後5年経過している規格の場合、現在関連文書等において、全規格揃えの対象外として相談することが可能な事例として記載されているものについては、供給停止・薬価削除プロセスを適用可能とされています。
一方で薬価基準収載時には、現在、後発医薬品の規格は、原則、先発品が有する規格を全て揃えて保険収載することを求められている中で、医療上必ずしも必要でないと考えられる規格については、厚生労働省に個別相談することとなっていますが、全規格揃えの対象外とすることが可能かについては、対象事例が具体化・明確化されていません。必要な規格を揃えつつ、規格揃えの原則の合理化を図るため、後発医薬品の全規格揃えの対象外とすることを相談できる事例として、今回新たに、以下の内容が示されました。 5)
・対象外としようとする規格が、先発品において追加収載された規格であり、成分内の数量割合が3%以下であることが十分に推察可能で、他規格を代替品として用いることが可能である場合
・対象外としようとする規格が、先発品の特許期間満了後5年以上経過している成分であって、成分内の数量割合が直近5年間で3%以下であり、他規格を代替品として用いることが可能である場合

引用:第17回医療用医薬品の安定確保策に関する関係者会議 資料5
今後、通知により、上記取り扱いが明示されるものと考えられます。
1) 後発医薬品の必要な規格を揃えること等について(2006年3月10日 医政発第0310001号)
https://www.mhlw.go.jp/bunya/iryou/kouhatu-iyaku/dl/06.pdf
2)「後発医薬品の必要な規格を揃えること等について」の一部改正について(2020年11月17日 医政経発1117第6号)
https://www.pmda.go.jp/files/000250574.pdf
3)後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会 報告書
https://www.mhlw.go.jp/content/10807000/001256227.pdf
4)医療用医薬品の供給停止及び薬価削除について
https://www.mhlw.go.jp/content/10807000/001285978.pdf
5)第17回医療用医薬品の安定確保策に関する関係者会議 令和6年10月21日
資料5 後発医薬品の全規格揃えについて
https://www.mhlw.go.jp/content/10807000/001318554.pdf



