
副作用と有害事象
副作用とは、医薬品との因果関係が否定されない医薬品の使用により生じた有害な反応です。英語ではadversedrugreaction、ADRと言います。一方、因果関係の有無を問わず、単に医薬品の使用によって生じたあらゆる好ましくない有害な反応を有害事象と呼びます。こちらは英語ではadverseevent、AEと言います。
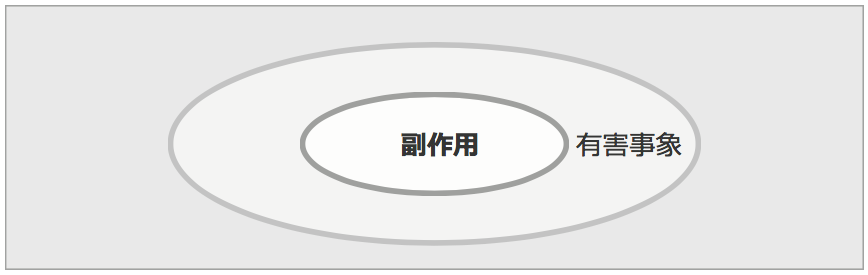
つまり因果関係を問わない有害な反応を有害事象、因果関係が否定できなければ、副作用となります。副作用は、有害事象の中に含まれます。
そこで因果関係が問題となります。因果関係の判定基準は各社ごとに手順書で決めていることと思います。
また、因果関係の区分を「確実、たぶん関係あり、可能性あり、たぶん関係なし、関係なし、不明」とした場合、どこまでを副作用とするのでしょう。この場合は、因果関係を完全に否定しているのは「関係なし」なので、「たぶん関係なし」、「不明」を含めて副作用として取り扱います。これは日本独自の考え方だと思います。欧米では、副作用に薬剤との合理的な可能性を求めているので、「たぶん関係なし(unlikely)」は副作用として扱いません。
副作用などを検討するために、使用成績調査を行うことがあると思いますが、医師に副作用を書いてもらうのではなく、有害事象と因果関係を書いてもらいます。これは医師が副作用と思っていない一見偶発的な有害事象が、実は未知の副作用であるということがあり得るので、未知の副作用も漏れなく拾い上げるために有害事象で情報を収集しています。ただし、医師の記載する因果関係は、因果関係が「否定できる」、「否定できない」で十分です。「たぶん関係なし」を入れると、併用されている他剤のものと思われる副作用まで、本薬を投与後に発現しているから、完全には否定できないということで、「たぶん関係なし」が選択されてしまいます。「たぶん関係なし」は副作用として扱わなければならないので、副作用のプロファイルを検討する時のノイズになってしまいます。
副作用は、因果関係が否定できない有害事象ですが、眠気の強い抗ヒスタミン薬から睡眠改善剤が生まれたり、狭心症の薬剤の開発中にEDの治療剤が生まれたりと、たまには良いこともありますね。
副作用の重篤と非重篤
ご存知のように重篤な副作用は、PMDAに報告が求められており、薬機法施行規則228条の20に重篤な副作用と報告期限が示されています。
重篤な副作用とは、死亡、障害、死亡又は障害につながるおそれのある症例、治療のために病院又は診療所への入院又は入院期間の延長が必要とされる症例、その他これに掲げる症例に準じて重篤である症例、後世代における先天性の疾病又は異常とされています。
どれかに該当すれば重篤になります。ただし、入院でも副作用が発現して検査のための入院であれば、治療目的ではないので重篤とはしません。これに加えて自動的に重篤として取り扱う副作用名を予め決めている会社もあります。
医師から非重篤として報告された副作用であっても、製造販売業者の責任で最終的な判断をする必要があります。患者の原疾患・合併症の状況、症状の推移、臨床検査値、転帰等を勘案して重篤性を判断することになります。
なお、重篤性を検討する際の参考資料として、CTCAEv4.0-JCOGがあります。
JGAニュースNo.102(2016年10月号)






