薬剤師国家試験過去問解説
本解説は、元大阪大谷大学薬学部教授、現在大阪医科薬科大学特別講師 廣谷芳彦先生に作成いただいたものです。薬学生の皆様のご参考になれば幸いです。
なお、国家試験の過去問は、厚労省が掲載している過去問及び回答を転載しております。
(ご参考)
厚労省Webサイト「薬剤師国家試験のページ」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/yakuzaishi-kokkashiken/index.html
第106回薬剤師国家試験問題及び解答(令和3年2月20日、2月21日実施)
【計7問】
1日目② 一般問題(薬学理論問題)【物理・化学・生物、衛生、法規・制度・倫理】
2日目① 一般問題(薬学実践問題)【物理・化学・生物、衛生/実務】
2日目② 一般問題(薬学実践問題)【薬理、薬剤/実務】
2日目③ 一般問題(薬学実践問題)【病態・薬物治療、法規・制度・倫理/実務、実務】
| 問題 |

|
|---|---|
| 解答 | 2 |
| 解説 |
医療・介護関係事業者における個人情報の適切な取扱いのためのガイダンスには、法令上、医療機関等(医療従事者を含む)が行うべき義務として明記されているものとして、 医師、薬剤師等の医薬関係者が行う厚生労働大臣への医薬品等の副作用・感染症等報告(医薬品医療機器等法第68条の10第2項)」が記載されています。その内容は、「薬局開設者,病院,診療所若しくは飼育動物診療施設の開設者又は医師,歯科医師,薬剤師,登録販売者,獣医師その他の医薬関係者は,医薬品,医療機器又は再生医療等製品について,当該品目の副作用その他の事由によるものと疑われる疾病,障害若しくは死亡の発生又は当該品目の使用によるものと疑われる感染症の発生に関する事項を知った場合において,保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは,その旨を厚生労働大臣に報告しなければならない。」と規定されています。また、問題文の第三者とは厚生労働大臣のみとなります。 そのため、2が正解となります。 (ご参考) 1. 医薬品医療機器総合機構「医薬品医療機器法に基づく副作用・感染症・不具合報告(医療従事者向け)」 https://www.pmda.go.jp/safety/reports/hcp/pmd-act/0003.html 2. 個人情報保護委員会/厚生労働省「医療・介護関係事業者における 個人情報の適切な取扱いのためのガイダンス (平成29年4月14日(令和2年10月一部改正)) https://www.mhlw.go.jp/content/000681800.pdf |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 1日目② 一般問題(薬学理論問題)【物理・化学・生物、衛生、法規・制度・倫理】 |
| 問題 |

|
| 解答 | 3 |
| 解説 |
再審査制度 は、新医薬品では治験の症例数には限りがあり、市販後多くの患者に使用された場合に未知の副作用が発現する可能性があります。また、治験では、患者の症状、年齢、併発している疾病、使用量、併用薬などがコントロールされているのに対し、治験での使用法と実際の医療の場での医薬品の使われ方が同じでないことから、新医薬品について、承認後一定期間が経過した後に、企業が実際に医療機関で使用されたデータを集め、承認された効能効果、安全性について、再度確認する、「再審査制度」が設けられています。再審査の結果は、 1. 承認の取り消し 2. 効能効果の削除又は修正 3. 特に措置なし のいずれかの措置となります。なお、3の場合であっても添付文書の改訂はなされる場合があります。 なお、再審査とは別に、「再評価制度」があり、それは一度、承認された医薬品であっても、年月の経過とともに、現在もっと効果の高い薬、安全性の高い薬が発売され、存在価値がなくなったり、現在の評価基準では有用性が認められないことがあり得ます。「再評価制度」には、既に承認されている医薬品について、現時点の医学・薬学等の学問水準に照らして、品質、有効性及び安全性を確認する制度です。新医薬品だけでなく、後発医薬品を含むすべての医薬品が対象となります。また、「再評価制度」には、有効性・安全性等を再評価する「薬効再評価」と、品質(溶出性)を再評価する「品質再評価」があります。「再審査制度」では、承認後その効能効果や安全性を確認するもので、治験の延長上にありますが、「再評価制度」では、市販後長期間経た後に現在の評価基準での有用性を確認する制度で、両制度の違いがあります。 1. 新薬が市販され多くの人が一定期間使用した後、目標とした効能・効果が得られているのか、予想しなかったような副作用が発生していないかなどについてデータを収集し再度検証します。そのため、承認後一定期間が経過した後に再審査を行いますので、誤りとなります。 2. 再審査期間の指定の規定では、新医薬品等の再審査期間は、製造販売承認または承認事項一部変更承認の際に厚生労働大臣によって指示される(通常は8年)とされているため、製造販売業者が厚生労働大臣に届出を行わないので誤りとなります。 3. 再審査申請添付資料には、 (1)使用成績調査に関する資料(調査方法、調査結果など) (2)特定使用成績調査に関する資料(調査方法、調査結果など) (3)製造販売後臨床試験に関する資料(調査方法、調査結果など) (4)副作用・感染症報告に関する資料 (5)研究報告に関する資料 (6)国内の措置に関する資料 (7)国外の措置に関する事項 (8)重篤な有害事象の発言に関する資料 がある。 4. 再審査期間を含む市販後の副作用報告は、製造販売業者のほかに医薬関係者からも報告の義務があるため、誤りとなります。 5.再審査の対象は新薬であり、後発医薬品は対象となっていないので誤りとなります。 (ご参考) 1. 厚生労働省医薬食品局審査管理課「再審査制度・再評価制度について」 https://www.cao.go.jp/consumer/history/01/kabusoshiki/tokuho/doc/110228_shiryou5.pdf 2. 医薬品医療機器総合機構「再審査」 https://www.pmda.go.jp/review-services/reexamine-reevaluate/re-examinations/0005.html 3. 日本ジェネリック製薬協会「医薬品の再評価について」 https://jga.gr.jp/jgapedia/deals/202002.html |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 1日目② 一般問題(薬学理論問題)【物理・化学・生物、衛生、法規・制度・倫理】 |
| 問題 |

|
| 解答 | 5 |
| 解説 |
選択肢1~4は、いずれも後発医薬品の使用促進策であります。選択肢1は、制度上、薬剤師が後発医薬品の調剤を行い易くしています。 選択肢2と3は、後発医薬品の使用の際の患者への説明と分割調剤は、患者の後発医薬品に対する不安を無くす目的で行われています。選択肢4は、後発医薬品を調剤した場合には、保険薬局に対しその使用量により調剤報酬として後発医薬品調剤体制加算が付与されます。なお、病院・診療所では、調剤体制加算の段階的評価の引き上げと後発医薬品使用体制加算の段階的評価の見直し(新指標に基づく計算方式に変更)、院内処方を行う診療所での外来後発医薬品使用体制加算の新設、DPC病院の機能評価係数Ⅱの後発医薬品指数の上限引き上げや 一般名処方のさらなる推進(後発医薬品が存在する全ての医薬品を一般名処方した場合の評価を追加)などの使用促進策が実施されています。選択肢5は、調剤技術料は、処方せんに基づくすべての医薬品に対して同率に設定されています。また、患者の自己負担額も同様にすべての医薬品に同率の金額に設定されています。そのため、後発医薬品と他の医療用医薬品も、調剤技術料及び患者負担額は同額になっています。 (ご参考) 1. 医療経済研究機構「後発医薬品のさらなる使用促進策について」 https://www5.cao.go.jp/keizai-shimon/kaigi/special/reform/committee/20200323/shiryou4_2_1.pdf 2. 日本ジェネリック製薬協会「後発医薬品使用促進ロードマップ検証検討事業のこれまでを振り返って」 https://www.jga.gr.jp/jgapedia/contribution/18.html |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 1日目② 一般問題(薬学理論問題)【物理・化学・生物、衛生、法規・制度・倫理】 |
| 問題 |
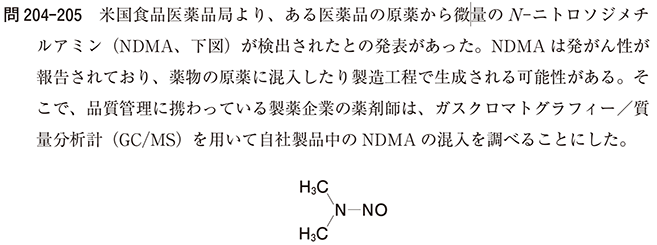 
|
| 解答 | 1,2 |
| 解説 |
この事例は、2018 年 6 月のスペイン当局からの、バルサルタン原薬に発がん性物質であるN‐ニトロソジメチルアミン(NDMA)が混入しているとの連絡を契機に、ニトロソアミンの医薬品中への混入について諸外国と同様に国内でも対応が行われ、あすか製薬のバルサルタン錠「AA」をはじめ回収等が行われた。同時に、服用中の患者に対しては、自己判断で服用を中止することなく、医療関係者と相談するようにとの指示もありました。 なお、自主回収のクラス分類でのクラス分類とは、回収される製品によりもたらされる健康への危険度の程度により、以下のとおり個別回収ごとに、I、II又はIIIの数字が割り当てられるものです。 クラスI:その製品の使用等が、重篤な健康被害又は死亡の原因となりうる状況をいう。 クラスII:その製品の使用等が、一時的な若しくは医学的に治癒可能な健康被害の原因となる可能性があるか又は重篤な健康被害のおそれはまず考えられない状況をいう。 クラスIII:その製品の使用等が、健康被害の原因となるとはまず考えられない状況をいう。 実際には、自主回収と薬局の対応で薬局薬剤師の取るべき行動として、選択肢1と2のように、医薬品医療機器総合機構(PMDA)のホームページから、回収対象のロットや回収理由、危惧される具体的な健康被害などの情報を入手するとともに、当該製品の処方歴がある患者のリストを作成します。一方、製造販売業者は、患者向けには、「可能な限り早々に処方された医療機関等もしくは調剤薬局にお手持ちの薬剤をお持ちいただくようお願い申し上げる」とし、回収を行います。そのため、選択肢3のように患者が手持ちの医薬品を使用しないように伝える。 また、回収を行うため、選択肢5のように薬局内で廃棄処分はできません。この事例では、医師、薬剤師への相談なく製品の服用を中止することは胃・十二指腸潰瘍などの症状を悪化させるリスクがあるとしていますので、処方医により治療変更を行うことになる。そのため、選択肢4のように薬局薬剤師の判断で他の成分の製品に変更することはできません。 (ご参考) 1. 厚生労働省「医薬品等回収関連情報」 https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/kaisyu/index.html 2. 厚生労働省医薬・生活衛生局医薬品審査管理課「後発医薬品品質情報No.13(令和2年3月) 」 https://www.mhlw.go.jp/content/000610643.pdf |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 2日目① 一般問題(薬学実践問題)【物理・化学・生物、衛生/実務】 |
| 問題 |
 
|
| 解答 | 2,3 |
| 解説 |
後発医薬品では、溶出試験と、20人ほどの健康成人においてクロスオーバー法で先発医薬品と後発医薬品の常用量を投与し、血中濃度の推移を比較する生物学的同等性試験を行うことにより、先発医薬品と同等の有効性と安全性の根拠としています。また、先発医薬品と添加物が異なることによって薬剤の溶出性が変わることがあるので、その品質と安全性を確認する目的で溶出試験を行い、溶出挙動が同じであることの証明が義務付けられています。それらの理由で選択肢2と3は正解です。選択肢4について、有効成分が同じである後発医薬品が、先発医薬品で実施された臨床試験を重複して行うことは、時間と経費の無駄であり、安価なジェネリック医薬品を早く提供するという趣旨に反するとの考え方に基づき、1984年に米国において、ジェネリック医薬品の簡略承認申請を認めたハッチ・ワックスマン法が成立し、これが世界的なスタンダードとなり、日本でも採用されています。そのため、第Ⅰ~第Ⅲ相試験は行いません。同様に、選択肢1のように動物を用いた薬力学的試験も不要となっています。 また、市販調査も先発医薬品と同一成分であるため、後発医薬品では市販後調査は義務付けられていないので選択肢5は誤りとなります。 (ご参考) 1. 日本ジェネリック製薬協会「【対談】ジェネリック医薬品の臨床効果は先発医薬品と同等と言えるのか?」 https://www.jga.gr.jp/jgapedia/interview/discussion.html 2. 厚生労働省医薬食品局審査管理課「後発医薬品品質情報No.2」クロスオーバー試験 → https://www.mhlw.go.jp/file/06-Seisakujouhou-11120000-Iyakushokuhinkyoku/h2612_3.pdf |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 2日目② 一般問題(薬学実践問題)【薬理、薬剤/実務】 |
| 問題 |

|
| 解答 | 2,5 |
| 解説 |
生物学的同等性試験では、健康成人に先発医薬品と後発医薬品を交互に服用後、血中濃度を測定します。経口投与された医薬品は胃で崩壊・溶出し、小腸に移行して吸収され、門脈を通って肝臓に運ばれ、代謝を受けた後に全身循環へと移行します。一般的に全身循環血の血中濃度と薬効はよく相関しますので、薬物の吸収量を表すAUC(血中濃度-時間曲線下面積)と吸収速度を表すCmax(最高血中濃度)の2つのパラメーター を用いて、比較を行います。そのため、選択肢2と5が正解となります。 (ご参考) 1. 日本ジェネリック製薬協会「BE試験」 https://www.jga.gr.jp/information/jga-news/2019/131/07.html |
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 2日目② 一般問題(薬学実践問題)【薬理、薬剤/実務】 |
| 問題 |
 
|
| 解答 | 4 |
| 解説 |
バイオ後続品(バイオシミラー)は、薬事承認上は新薬と後発医薬品とは異なる取扱いを受けます。後発医薬品は、品質特性解析による先発医薬品との有効成分の同一性の確認と、生物学的同等性試験による血中濃度推移に関する評価が行われますが、バイオ後続品は、複雑な構造、生物活性、不安定性、免疫原性等の品質特性から、先行バイオ医薬品との有効成分の同一性の検証が困難であります。そのため、品質特性解析によって品質特性に高い類似性を持つことを十分に検証した上で、さらに非臨床・臨床試験によって、先行バイオ医薬品と同じ効能・効果、用法・用量で使える(=同等/同質である)ことを検証しています。そのため、正解は選択肢4となります。
(ご参考) 1. 厚生労働省「バイオ医薬品・バイオシミラーを正しく理解していただくために」 https://www.mhlw.go.jp/content/10800000/000496081.pdf 2. 厚生労働省『「バイオ後続品の品質・安全性・有効性確保のための指針」について』 https://www.mhlw.go.jp/hourei/doc/tsuchi/T20200206I0010.pdf 3. 日本ジェネリック製薬協会「バイオシミラー啓発スライド(IGBA)」 https://www.jga.gr.jp/jgapedia/column/037.html 4. 日本ジェネリック製薬協会「ジェネリック医薬品及びバイオシミラーの使用促進に向けて」 https://www.jga.gr.jp/jgapedia/contribution/06.html 引用元:薬食発第0304004 号平成21年3月4日(別表1)(別表2-(1)医療用医薬品) https://www.nihs.go.jp/dbcb/TEXT/yakusyokuhatu-0304004.pdf  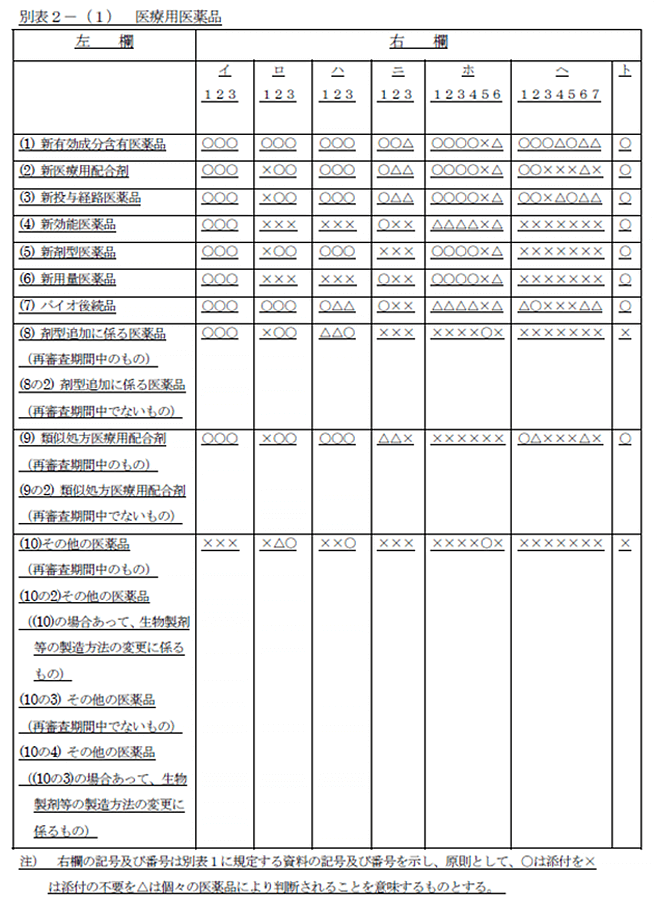
|
| 出題傾向 |
第106回薬剤師国家試験問題(令和3年2月20日、2月21日実施) 2日目③ 一般問題(薬学実践問題)【病態・薬物治療、法規・制度・倫理/実務、実務】 |
第105回薬剤師国家試験問題及び解答(令和2年2月22日、2月23日実施)
【計1問】(1日目(2) 一般問題(薬学理論問題))
| 問題 |

|
|---|---|
| 解答 | 1,3 |
| 解説 |
1.薬価基準は、保険医療で使用できる医薬品の品目表と価格表の2つの性格を持つ。 【解説】 薬価基準は、医療保険から保険医療機関や保険薬局(保険医療機関等)に支払われる際の医薬品の価格を定めたもので、厚生労働大臣が官報に告示します。現在(令和元年9月)、医療機関等で保険診療に用いられる医療用医薬品として薬価基準に収載されている品目は約1万6千程度あり、薬価基準収載品目リストには各医薬品の有効成分の名称(品目)別に1錠あるいは1gなど規格当たりの価格が示されています。そのため、設問1は正解となります。 2.新医薬品は、製造販売の承認から遅くとも30日以内に薬価基準に収載される。 【解説】 「新医薬品」は、医薬品医療機器法第十四条の四に定められる既に承認を与えられている医薬品と有効成分、分量、用法、用量、効能、効果等が明らかに異なる医薬品であり、主に、新有効成分含有医薬品、新医療用配合剤、新投与経路医薬品、新効能医薬品、新剤型医薬品、新用量医薬品などが該当します。また、新医薬品では、薬価基準への収載の日に属する月の翌月から起算して1年を経過していないものという定義があり、この期間は14日間の投与制限があります。新医薬品の薬価基準収載が施行されるまでの標準的な事務処理期間は、特にやむを得ない正当な理由がある場合を除き、当該新医薬品の承認から原則として60日以内、遅くとも90日以内とすると定められています。そのため、この設問は誤りです。なお、医薬品の薬価収載(保険収載)時期については、新医薬品は年4回、後発医薬品では年2回の基本的なルールが定められています。 (ご参考) 「療担規則及び薬担規則並びに療担基準に基づき厚生労働大臣が定める掲示事項等」(平成18.3.6 厚生労働省告示第107号)第十 厚生労働大臣が定める注射薬等 https://www.mhlw.go.jp/web/t_doc?dataId=84aa7837&dataType=0&pageNo=1 3.新医薬品の薬価は、類似薬がある場合は、その薬価を参考に決められる。 【解説】 新医薬品の薬価は、類似薬がある場合には類似薬効比較方式という方法で薬価の算定が行われます。これは、対象疾患や作用機序、投与経路などが最も似ている最類似薬を基準に薬価を決める方法です。なお、類似薬効比較方式は、その新薬に新規性により2つに分かれます。新規性があると判断された新薬に適用される類似薬効比較方式(I)では、類似薬とは違う新規の作用機序を持っていたり、既存薬を上回る有効性・安全性が示されていたりする場合には、補正加算によって薬価が上乗せされます。一方、新規性が乏しいと判断されれば類似薬効比較方式(II)で算定が行われますが、この場合には補正加算はつきません。このように新医薬品の薬価は、類似薬がある場合にはその薬価を参考に決められますので、設問3は正解です。 4.既収載品の薬価は、年間販売量が多いものに限り定期的に見直される。 【解説】 薬価基準で定められた既収載品の薬価は、医療機関や薬局での実際の販売価格(市場実勢価格)を調査(薬価調査)し、年間販売量にかかわらずその結果に基づき毎年改定されます。「年間販売量が多いものに限り」が誤りとなります。 5.後発医薬品の薬価は、製造販売業者が自由に決められる。 【解説】 後発医薬品を含む医薬品の薬価は、中央社会保険医療協議会がとりまとめた「薬価算定の基準について」に基づき、厚生労働大臣が定めます。実際には、後発医薬品が初収載される場合、基本的には先発医薬品の薬価の0.5掛けですが、内用薬については収載希望品目数が10品目を超えた場合に先発医薬品の薬価の0.4掛けとなります。収載後、薬価は市場実勢価格により改定を経るに従って低下していきます(日本ジェネリック医薬品協会(JGA)ホームページ参照)。後発医薬品を含むすべての医療用医薬品は、厚生労働大臣が定めますので、この設問は誤りです。 |
| 出題傾向 |
第105回薬剤師国家試験問題及び解答(令和2年2月22日、2月23日実施) 1日目(2) 一般問題(薬学理論問題) |
第104回薬剤師国家試験(平成31年2月23日、2月24日実施)
【計2問】(1日目(1) 必須問題、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 3 |
| 解説 |
先発医薬品のムコダイン錠250 mgを分割調剤でL-カルボシステイン錠 500 mgを残り21日分(28日分-7日分=21日分)を調剤するので、用法から1日3錠であるので、3錠/日x 21日=63錠が残りの調剤数の最大錠数となる。 なお、30年度診療報酬改定により、分割調剤(最大3分割まで)に係る医師の指示や分割調剤を行った際の手続きの明確化・合理化を図ったほか、医療機関と薬局の連携による医薬品の適正使用を推進するため、残薬に係る疑義照会の取り扱いを明確にした。この改訂に伴い、分割調剤に係る処方箋様式が新たに追加され、さらに分割指示に係る処方箋(別紙)には保険薬局が薬局情報を記載しなければならない。 |
| 出題傾向 |
第104回薬剤師国家試験問題及び解答(平成31年2月23日、2月24日実施) 1日目(1) 必須問題 |
| 問題 |

|
| 解答 | 2,4 |
| 解説 |
本問題は、剤形変更に伴う通常量での処方量の適正化の判断と当該患者に対する服用量の計算問題であるが、処方箋に記載している服用量の疑義照会と処方提案を行う問題である。 設問内記載されているアセトアミノフェンの添付文書での通常量(成分量)は、1回量10~15 mg/kg で患者の体重が20 kgであるので、1回量が200~300mgとなる。処方に記載されているアセトアミノフェンシロップ2%の8 mLの1回量は、 100 mL : 2g = 8 mL : x g の比例計算で、x = 0.16 g(160 mg)となり、200 mgより少ないので、選択肢2の「アセトアミノフェンの1回量が不足であることを疑義照会する。」となる。次に、アセトアミノフェン1回量の適正量である0.2 g (200 mg) は、アセトアミノフェン細粒20 %の製剤量yは、 100 g : 20g = y g : 0.2 g の比例計算で、y =1 g/回となり 疑義照会の際に、選択肢4の「アセトアミノフェン細粒20 %1回量1 g、5回分への処方提案をする。」が解答となる。 |
| 出題傾向 |
第104回薬剤師国家試験問題及び解答(平成31年2月23日、2月24日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療、法規・制度・倫理/実務、実務】 |
第103回薬剤師国家試験(平成30年2月24日、2月25日実施)
【計2問】(2日目(3) 一般問題(薬学実践問題)、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 2、4 |
| 解説 |
この問題は、患者さん家族からの服用に関する要望に対して、薬剤師がどのように対応すべきかを問う問題である。この問題の様に、嚥下困難な事例であり高齢者に多く見られる。後発医薬品(ジェネリック医薬品)には、先発医薬品にはない剤形があり、患者さんが服用し易く工夫されているものもある。この患者さんは、錠剤やカプセル剤のような固形物の服用が難しいため、水剤や散剤が考えられるが、選択肢にある様に、錠剤を粉砕するか口腔内崩壊錠(Orally Disintegrating Tablets:OD錠)への変更も考えられる。なお、口腔内崩壊錠は唾液や少量の水で速やかに崩壊するので、嚥下能力(食べ物や薬を飲み込む力)が低下した患者さんにも飲みやすくなっている。 1.一包化を行っても錠剤の固形物であり、服用ができないので不正解である。通常は、一包化は、服用薬が数種類あり、飲み忘れや服用漏れが有る場合などに行う。 2.固形物でないので、正解である。 3.固形製剤を服用するため患者さんの要望に応えていないので、不適切な対応である。 4.固形物の錠剤であるが口腔内で唾液により崩壊するので嚥下が難しい患者さんにも使用ができるので、正解である。 5.固形製剤を服用するので患者さんの要望に応えていないので、不適切な対応である。 |
| 出題傾向 |
第103回薬剤師国家試験問題及び解答(平成30年2月24日、2月25日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療、法規・制度・倫理/実務、実務】 |
| 問題 |
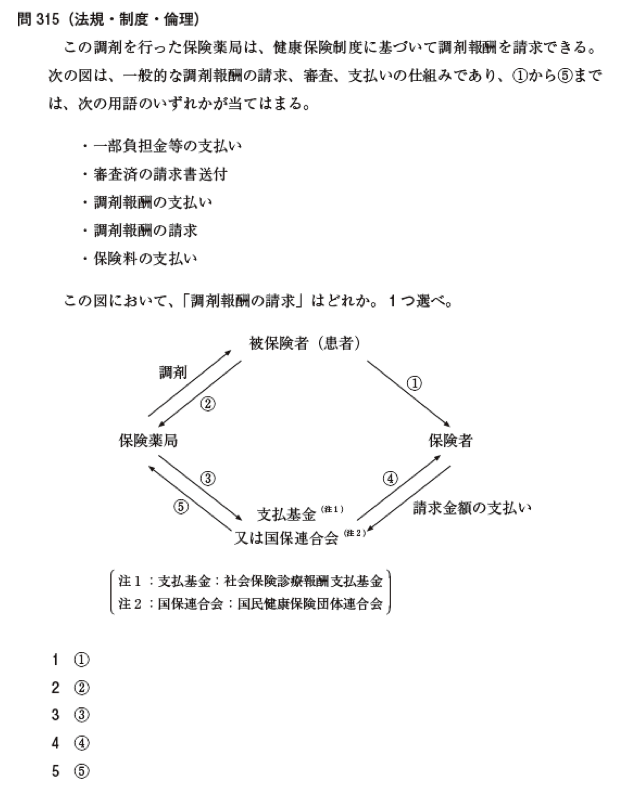
|
| 解答 | 3 |
| 解説 |
本問題は、保険薬局における社会保険制度のしくみについての問題である。設問中の調剤報酬の請求は、選択肢(3)の保険薬局が審査・支払機関である社会保険診療報酬支払基金か国民健康保険団体連合会に対して行う。なお、設問中に示されていた調剤報酬の請求、審査、支払いの仕組みの図の中の (1)は保険料の支払い、(2)は一部負担金(医療にかかった費用)等の支払い、(3)は医療費(調剤報酬)の請求、(4)は審査済みの請求書送付、(5)は医療費(調剤報酬)の支払いとなる。 |
| 出題傾向 |
第103回薬剤師国家試験問題及び解答(平成30年2月24日、2月25日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療、法規・制度・倫理/実務、実務】 |
第102回薬剤師国家試験(平成29年2月25日、2月26日実施)
【計2問】(1日目(1) 必須問題、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 1 |
| 解説 |
後発医薬品(ジェネリック医薬品)を申請する際には、通常、以下の3つの資料と添付文書記載事項(添付文書案)を提出する必要がある。(GE薬協サイトへリンク参照) (1)「規格及び試験方法に関する資料」(物理的化学的性質並びに試験方法に関する資料) (2)「加速試験に関する資料」(安定性に関する資料) (3)「生物学的同等性に関する資料」(吸収、分布、代謝、排泄に関する資料) そのため、1の加速試験に関する資料が正解となる。 (ご参考「GE薬協Webサイト 医療関係者の方向け情報>ジェネリック医薬品について>3. ジェネリック医薬品の承認申請) https://www.jga.gr.jp/medical/about/generic03.html 【ご参考】 ジェネリック医薬品パーフェクトBOOK 改訂第2版 第3章(サンプル) ジェネリック医薬品の承認申請において提出される、「規格及び試験方法に関する資料」,「安定性試験に関する資料」,「生物学的同等性に関する資料」の3つの資料の概要について解説しています。 出版元 南山堂 ジェネリック医薬品パーフェクトBOOK 改訂第2版 ※外部サイトへ遷移します。 |
| 出題傾向 |
第102回薬剤師国家試験問題及び解答(平成29年2月25日、2月26日実施) 1日目(1) 必須問題 【物理・化学・生物、衛生、薬理、薬剤、病態・薬物治療、法規・制度・倫理、実務】 |
第101回薬剤師国家試験(平成28年2月27日、2月28日実施)
【計3問】(1日目(1) 必須問題、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 1,4 |
| 解説 |
本問題は、調剤時における保険薬局業務に関する問題で、 1. ○ 調剤を行う場合は、患者の服薬状況及び薬剤服用歴などを確認しなければならない。 2. × 保険薬剤師は、患者の調剤を行った場合には調剤後遅滞なく調剤録に必要事項を記載しなければならないので、不正解である。 3. × 麻薬処方箋に限らず調剤済みとなった麻薬処方箋の保管期間は、3年間であるので不正解である。 4. ○ 保険薬局及び保険薬剤師療養担当規則第8条に後発医薬品(ジェネリック医薬品)への変更時説明を適切に行わなければならないと記載されており、さらにこの場合において、保険薬剤師は、後発医薬品(ジェネリック医薬品)を調剤するよう努めなければならないとしている。なお、保険薬剤師療養担当規則第七の二には、後発医薬品(ジェネリック医薬品)の備蓄に関する体制その他の後発医薬品(ジェネリック医薬品)の調剤に必要な体制の確保に努めなければならないと記載している。 |
| 出題傾向 |
第101回薬剤師国家試験問題及び解答(平成28年2月27日、2月28日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療、法規・制度・倫理/実務、実務】 |
| 問題 |

|
| 解答 | 4 |
| 解説 |
病院での医薬品採用では、各診療科・中央診療部門などから提出された医薬品採用願を提出し、薬事委員会でその医薬品の採用の可否を審議し、薬剤部は多くの病院でその事務局業務を担っている。 1. × 医療用医薬品製品情報概要は、医薬品の普及並びに適正使用を推進するために、当該医薬品の概略を記載した印刷物で、医療用医薬品添付文書や総合的に医薬品解説をしている医薬品インタビューフォームと比較すると信頼性が低いため、採用時の資料として重要視されないので、不正解である。 2. × 新しい作用機序をもつ医薬品は重要な採用要件であるが、採用済みの同種同効薬と比較して、安全性や製剤上などの優位性が見られるか薬事委員会で審議し、採用を決定するので、不正解である。 3. × 後発医薬品(ジェネリック医薬品)の採用では、購入価格だけでなく、剤形や添加剤、適応症、安定供給、製造メーカーの情報提供体制、さらには一包化の是非などを考慮して採用を決定するので、不正解である。 4. ○ 薬事委員会などを設置し採否について審議するので、正解である。 5. × 新規医薬品採用時の安全性評価において、海外の臨床試験データが有る場合は、参考にするので、不正解である。 |
| 出題傾向 |
第101回薬剤師国家試験問題及び解答(平成28年2月27日、2月28日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療、法規・制度・倫理/実務、実務】 |
第100回薬剤師国家試験(平成27年2月28、3月1日実施)
【計3問】(1日目(2) 一般問題(薬学理論問題)、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 2,4 |
| 解説 |
本問題は、保険薬局及びに保険薬剤師療養担当規則(以下、薬担規則)に関する基本的な内容の問題である。 1. × 薬担規則 3 条により、患者の被保険者証の記号・番号、保険者名、生年月日、非保険者と被扶養者の区別を調剤録に記載しなければならないので、患者に被保険者証を提示して頂き、必要事項を確認する。 2. ○ 薬担第七条の二には、保険薬局は後発医薬品(ジェネリック医薬品)の備蓄に関する体制の確保に努めなければならないと記載している。 3. ×薬担規則第二条の三の一において、保険医療機関と一体的な経営を行うことは禁じられている。 4. ○ 薬担第七条二号には、保険薬局は患者が不正行為により療養の給付を受けたときは意見を付して、その旨を全国健康保険協会又は当該健康保険組合に通知しなければならないと記載している。 |
| 出題傾向 |
第100回薬剤師国家試験問題及び解答(平成27年2月28、3月1日実施) 1日目(2) 一般問題(薬学理論問題) |
| 問題 |


|
| 解答 | 4 |
| 解説 |
本問題は、後発医薬品(ジェネリック医薬品)への変更に関する問題である。 1. ○ 変更不可の「✔」が有るため、後発医薬品(ジェネリック医薬品)に変更できないのでこのまま調剤する。 2. ○ 変更不可の「✔」がなく、先発医薬品名で処方されている場合では、後発医薬品(ジェネリック医薬品)の説明を行ったうえで患者が変更を希望した場合は、後発医薬品(ジェネリック医薬品)を調剤する。 3. ○ 処方2と同じく、変更不可の「✔」がなく、先発医薬品名で処方されている場合は、後発医薬品(ジェネリック医薬品)の説明をするが患者が先発医薬品を希望する場合はそのまま調剤する。 4. ×処方4では、一般名処方なので、患者に対して後発医薬品(ジェネリック医薬品)の説明を適切に行うと伴に、後発医薬品(ジェネリック医薬品)を使用するように努めなければならないので、後発医薬品(ジェネリック医薬品)を調剤することは可能である。なお、一般名処方が行われた医薬品について、後発医薬品(ジェネリック医薬品)を調剤しなかった場合は、その理由を調剤報酬明細書の摘要欄に記載することになっている。 5. ○ 在庫がない場合で、患者の了解が得られれば医師に確認しないで同一金額以下で同一成分の別銘柄の後発医薬品(ジェネリック医薬品)を調剤することができる。 |
| 出題傾向 |
第100回薬剤師国家試験問題及び解答(平成27年2月28、3月1日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
| 問題 |


|
| 解答 | 2,3 |
| 解説 |
本問題は、後発医薬品(ジェネリック医薬品)の最も基本的な事項についての問題である。 1. × 後発医薬品(ジェネリック医薬品)は、先発医薬品の再審査が終了し特許期間が終了した後に市場で提供される。 2. ○ 後発医薬品(ジェネリック医薬品)は、先発医薬品と同一の有効成分を同量含んでいるので同等の臨床効果、作用が得られる医薬品ですと説明できる。 3. ○ 後発医薬品(ジェネリック医薬品)は、先発医薬品と比べて研究開発費が少ないために、価格(薬価)が安くなっている。 (ご参考「GE薬協Webサイト 医療関係者の方向け情報>ジェネリック医薬品について> 1. ジェネリック医薬品とは(ジェネリック医薬品の開発費と薬価)) https://www.jga.gr.jp/medical/about/generic01.html 4. × 後発医薬品(ジェネリック医薬品)に含まれる添加剤に関しては、後発医薬品(ジェネリック医薬品)メーカーによって異なるのでどれも先発医薬品と同一であるとはいえない。 5. × 日本の使用割合は、72.6 %(2018年12月発表分)で欧米諸国と比べかなり追いついてきたが、90%以上のアメリカなどと比較して低い状況にある。 |
| 出題傾向 |
第100回薬剤師国家試験問題及び解答(平成27年2月28、3月1日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
第99回薬剤師国家試験(平成26年3月1、2日実施)
【計4問】(1日目(1) 必須問題、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 3 |
| 解説 |
後発医薬品(ジェネリック医薬品)の審査では、「規格試験及び試験方法」「安定性試験」「生物学的同等性試験」に関する3つの資料の提出が求められる。本問題である「規格及び試験方法」には、有効成分の確認試験(定量法)、含量規格、性状、純度試験、溶出性などの試験がある。 これらの試験を通して、先発医薬品と同じ有効成分を同量含有し、純度、不純物の程度も同じレベルで、製剤の薬物動態も同様であることを確認している。その結果、後発医薬品(ジェネリック医薬品)は、先発医薬品と同一の有効成分を同一量含有し、同一経路から投与する製剤として使用される。よって、同一であることが必要なのは3の「有効成分の含量」である。 |
| 出題傾向 |
第99回薬剤師国家試験問題及び解答(平成26年3月1、2日実施)_IFC 1日目(1) 必須問題 【物理・化学・生物、衛生、薬理、薬剤、病態・薬物治療、法規・制度・倫理、実務】 |
| 問題 |

|
| 解答 | 2 |
| 解説 |
調剤済みとなった保険処方箋には、薬剤師法(第26条第1項[処方せんへの記入等])により ・調剤済みの旨(調剤済みとならなかった場合は調剤量) ・調剤年月日 ・薬剤師の記名押印又は署名 また、薬剤師法施行規則(第15条第1項[処方せんの記入事項])には、さらに ・調剤した薬局等の名称及び所在地 ・処方箋に記載された医薬品を変更して調剤した場合には、その変更内容 ・疑義照会した場合は、その回答内容 を記載する必要がある。そのため、調剤済みとなった保険処方箋には、後発医薬品(ジェネリック医薬品)への変更希望の有無は記載が不要である。但し、処方変更がある場合には記載する必要がある。正解は2となる。 |
| 出題傾向 |
第99回薬剤師国家試験問題及び解答(平成26年3月1、2日実施)_IFC 1日目(1) 必須問題 【物理・化学・生物、衛生、薬理、薬剤、病態・薬物治療、法規・制度・倫理、実務】 |
| 問題 |

|
| 解答 | 2 |
| 解説 |
1. × ダイレクト OTC とは、医療用医薬品として使用経験のない新成分を含む一般用医薬品である。代表例は、リアップアンチスタックスがある。 2. ○ スイッチ OTC とは、医療用医薬品の有効成分が一般医薬品に転用(スイッチ)された一般用医薬品である。 3. × オーファンドラッグ(希少疾病用医薬品)とは、患者数が日本国内で5万人に達していない疾病に用いられる医薬品で、かつ、その使用価値が特に高いものである。これらの疾病のための医薬品の開発促進のためオーファンドラッグに指定された薬の開発については助成金の提供や優先的承認審査などが行われる。 4. × 後発医薬品(ジェネリック医薬品)とは、先行する医療用医薬品(先発医薬品)と同等の臨床効果・作用が得られると認められた医薬品で、先発医薬品の特許期間が切れた後に発売される。 5. × 処方箋医薬品とは、医療用医薬品の中で、医師が発行する処方箋がなければ使用する事ができない医薬品のことである。 |
| 出題傾向 |
第99回薬剤師国家試験問題及び解答(平成26年3月1、2日実施)_IFC 1日目(1) 必須問題 【物理・化学・生物、衛生、薬理、薬剤、病態・薬物治療、法規・制度・倫理、実務】 |
| 問題 |

|
| 解答 | 3,4 |
| 解説 |
1. × 処方箋に「特に記載がある場合を除き、交付の日を含めて4日以内に保険薬局に提出すること」と記載されているため、処方箋の使用期限欄の記載がなくても問題ない。 2. × 本処方箋の交付の日は、平成26年2月27日であり、平成26年(閏年でない)3月2日以内(交付日を含めて4日以内)に保険薬局に提出すればよいため、処方箋の使用期限を過ぎていない。 3. ○ 処方欄の余白には、偽造処方箋作成を防止するため、「以下余白」により余白である旨を表示する必要がある。本処方箋には「以下余白」の記載がないため、不備がある。 4. ○ 処方2の用法が記載されていないため、本処方箋の用法の記載に不備がある。 5. × 後発医薬品(ジェネリック医薬品)へ変更してもよい場合、医師は変更不可欄に署名又は記名押印はしないため、変更不可欄に医師の署名がないことは問題ではない。 なお、この処方箋様式は現在(2019年11月)使用されていない。但し、変更不可に基本的な変更はない。 |
| 出題傾向 |
第99回薬剤師国家試験問題及び解答(平成26年3月1、2日実施)_IFC 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
第98回薬剤師国家試験(平成25年3月2、3日実施)
【計5問】(1日目(1) 必須問題、2日目(2) 一般問題(薬学実践問題)、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 1 |
| 解説 | 後発医薬品(ジェネリック医薬品)を対象としていない制度は、選択肢1の再審査制度である。再審査制度は、新医薬品又は新医療機器に対して適用される制度であり、市場における品質、有効性、安全性の再確認を行うものである。新医薬品の承認後、承認された日から通常8年後に、その医薬品の安全性や有効性について、厚生労働省の審査を受けることが義務付けられている。なお、再評価制度、副作用・感染症報告制度、医薬品・医療機器等安全性情報報告制度、医薬品副作用被害救済制度については、先発医薬品だけでなく後発医薬品(ジェネリック医薬品)も対象となる。なお、再審査制度と類似した再評価制度とは、再審査とは別に、必要に応じて医薬品の有効性などを確認できる制度で、再評価を行うことによって効能・効果表記の一部変更や一部削除が行われる場合がある。 |
| 出題傾向 |
第98回薬剤師国家試験問題及び解答(平成25年3月2、3日実施) 1日目(1) 必須問題 【物理・化学・生物、衛生、薬理、薬剤、病態・薬物治療、法規・制度・倫理、実務】 |
| 問題 |

|
| 解答 | 1 |
| 解説 | 先発医薬品と後発医薬品(ジェネリック医薬品)については、有効成分が同一であることは必須ではあるが、添加剤、効能・効果、剤形が異なるものがある。また、先発医薬品に比べて味が改善され飲みやすくなっている後発医薬品(ジェネリック医薬品)も存在する。誤っているのは、選択肢1となる。 |
| 出題傾向 |
第98回薬剤師国家試験問題及び解答(平成25年3月2、3日実施) 2日目(2) 一般問題(薬学実践問題) 【薬理/実務、薬剤/実務】 |
| 問題 |

|
| 解答 | 2,5 |
| 解説 |
「生物学的に同等である」とは、循環血液中に移行する薬物の速度と量が同等であることを示している。すなわち、通常医薬品の治療効果は吸収された有効成分の血中濃度と相関する。先発医薬品と後発医薬品(ジェネリック医薬品)での製剤間の生物学的同等性を規定する薬物動態パラメータには、選択肢2の最高血中濃度(Cmax)、最高血中濃度到達時間(Tmax)、選択肢5の血中濃度時間曲線下面積(AUC)がある。 (ご参考「GE薬協Webサイト 3. ジェネリック医薬品の承認申請」) https://www.jga.gr.jp/medical/about/generic03.html |
| 出題傾向 |
第98回薬剤師国家試験問題及び解答(平成25年3月2、3日実施) 2日目(2) 一般問題(薬学実践問題) 【薬理/実務、薬剤/実務】 |
| 問題 |

|
| 解答 | 1,4 |
| 解説 |
分割調剤に係る調剤報酬を算定できるのは以下の場合である。 ・先発医薬品を初めて後発医薬品(ジェネリック医薬品)に変更して調剤を行う場合であって、患者の希望により後発医薬品(ジェネリック医薬品)を試用する場合(選択肢1の場合) ・長期投与(14日分を超える投薬)にかかる処方箋において、安定性が保証できない等の理由により薬剤の保存が長期間困難である場合(選択肢4の場合) 選択肢3と5は、分割調剤に係る調剤報酬は算定できない。選択肢2は、調剤そのものが認められていない。なお、平成30年度診療報酬改定では、分割調剤の手続きが明確され、それに伴い分割指示に係る処方箋が新たに作成された。 |
| 出題傾向 |
第98回薬剤師国家試験問題及び解答(平成25年3月2、3日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
| 問題 |

|
| 解答 | 4 |
| 解説 |
医薬品名が一般名で記載されている処方箋を調剤する際には、患者に先発医薬品又は後発医薬品(ジェネリック医薬品)の使用に関する意向を確認後、患者の意向に添った調剤を行う必要がある。 なお、平成26年度調剤報酬改定において、一般名処方の際に後発医薬品(ジェネリック医薬品)を調剤しなかった場合は、その理由を調剤報酬明細書の摘要欄へ記載することとなった。それは、薬剤服用歴管理指導料の算定上の留意事項に新しく追加された事項には「一般名処方が行われた医薬品について、原則として後発医薬品が使用されるよう、患者に対し後発医薬品の有効性、安全性や品質について懇切丁寧に説明をした場合であって、後発医薬品を調剤しなかった場合は、その理由を調剤報酬明細書の摘要欄に記載する。」とある。 |
| 出題傾向 |
第98回薬剤師国家試験問題及び解答(平成25年3月2、3日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
第97回薬剤師国家試験(平成24年3月3、4日実施)
【計3問】(1日目(2) 一般問題(薬学理論問題)、2日目(3) 一般問題(薬学実践問題))
| 問題 |

|
|---|---|
| 解答 | 2,4 |
| 解説 |
1. × 平成26年度の医薬品生産金額のうち、一般用医薬品の占める割合は、10.6%である。 2. ○ 国民医療費は、保険料、公費、その他(患者の一部負担金等)で賄われている。 3. × 現在、医薬品の薬価は、1年ごとに改定される。 4. ○ 薬剤経済分析とは、医薬品や医療技術の費用対効果を評価する方法である。薬剤経済分析の手法には、費用最小化分析、費用効果分析、費用効用分析、費用便益分析 などがある。 |
| 出題傾向 |
第97回薬剤師国家試験問題及び解答(平成24年3月3、4日実施) 1日目(2) 一般問題(薬学理論問題) 【物理・化学・生物、衛生、法規・制度・倫理】 |
| 問題 |

|
| 解答 | 3,4 |
| 解説 |
1. × 医薬分業率は、外来処方件数に対する保険薬局への処方箋枚数の割合である。 2. × 医薬分業の機能を活かすためには、医療機関の医師と、調剤を行う薬局薬剤師が独立して職務にあたりそれぞれの観点から、最良の薬物治療に貢献することが求められている。そのため、保険薬局は、保険医療機関と経営的に独立していなければならない。 3. ○ 調剤された後発医薬品(ジェネリック医薬品)の割合に応じて、後発医薬品調剤体制加算を調剤基本料に加算することができる。調剤された後発医薬品の割合に応じて、算定する調剤報酬が異なる。 4. ○ 保険調剤を受けた者に交付する領収書には、個別の費用ごとに区分して調剤報酬の内容を記載する必要がある。なお、2010年4月から、医療機関や薬局の窓口で、原則として全患者に領収書に加え、調剤明細書の無償交付が義務づけられている。調剤明細書には、調剤報酬の内容がくわしく記載されている。 (ご参考「日本薬剤師会Webサイト 医薬分業について」) https://www.nichiyaku.or.jp/activities/division/about.html |
| 出題傾向 |
第97回薬剤師国家試験問題及び解答(平成24年3月3、4日実施) 1日目(2) 一般問題(薬学理論問題) 【物理・化学・生物、衛生、法規・制度・倫理】 |
| 問題 |

|
| 解答 | 1,2 |
| 解説 |
1. ○ 後発医薬品(ジェネリック医薬品)への変更調剤を行う場合、患者へ後発医薬品(ジェネリック医薬品)に関する説明を行い、同意を得る必要がある。 2. ○ 先発医薬品と後発医薬品(ジェネリック医薬品)では、適応症が異なることがある。そのため、先発医薬品を後発医薬品(ジェネリック医薬品)に変更する際には適応症について確認する必要がある。 (ご参考「GE協会Webサイト 効能効果、用法用量等に違いのある後発医薬品リスト」) https://www.jga.gr.jp/medical/confirm-effective.html 3. × 先発医薬品と後発医薬品(ジェネリック医薬品)へと変更する際、類似する別剤形への変更は可能である。この場合の錠剤と散剤では、類似する別剤形に該当しないため、錠剤の先発医薬品を散剤の後発医薬品(ジェネリック医薬品)に変更することはできない。内服薬を後発医薬品(ジェネリック医薬品)に変更調剤する場合は、以下に示す類似する剤形ごとに変更することが可能である。 (1)錠剤(普通錠)、錠剤(口腔内崩壊錠)、カプセル剤、丸剤 (2)散剤、顆粒剤、細粒剤、ドライシロップ剤(内服用固形剤として調剤する場合に限る) (3)液剤、シロップ剤、ドライシロップ剤(内服用液剤として調剤する場合に限る) 4. × 後発医薬品(ジェネリック医薬品)への変更調剤を行った場合は、処方発行の医療機関の医師に変更に伴う情報提供を行う必要がある。 5. × 後発医薬品(ジェネリック医薬品)への変更を行った場合、交付後の後発医薬品を先発医薬品に交換することはできない。そのため、新たに先発医薬品を手に入れるには改めて受診をし、新たな処方箋を手に入れる必要がある。 |
| 出題傾向 |
第97回薬剤師国家試験問題及び解答(平成24年3月3、4日実施) 2日目(3) 一般問題(薬学実践問題) 【病態・薬物治療/実務、法規・制度・倫理/実務、実務】 |
略歴
廣谷芳彦
昭和28年 大阪府生まれ
昭和52年 大阪薬科大学薬学科卒業
昭和54年 岡山大学大学院薬学研究科修士課程終了
昭和55年 大阪大学大学院薬学研究科博士課程中退
昭和55年 大阪大学医学部附属病院薬剤部入局
平成14年 大阪薬科大学薬学科着任(講師)
平成18年 大阪大谷大学薬学部着任(教授)
令和元年 大阪大谷大学薬学部特任教授
令和2年 大阪薬科大学特別講師として現在に至る
卒業後は、20年以上病院薬剤師として勤務。
大阪大谷大学では薬学部臨床薬剤学講座に所属し、研究以外にジェネリック医薬品促進活動、在宅医療支援活動、糖尿病の基礎研究から糖尿病の予防薬開発や早期発見・啓発活動とともに薬物乱用防止活動も行った。
所属学会は、日本薬学会、日本医療薬学会、日本TDM学会(評議員)、日本ジェネリック医薬品学会(評議員)、日本社会薬学会(関西支部副支部長)などに所属している。
他に、現在大阪府後発医薬品安心使用促進協議会専門委員、大阪府薬物乱用防止指導員、大阪府薬剤師会学術委員会委員、セルメディケーション協議会理事、日本薬学会近畿支部委員、などの学外活動を行っている。



