
東京理科大学経営学部教授
坂巻 弘之
 日本ジェネリック製薬協会(JGA GE薬協)の最新の統計によると、わが国のジェネリック医薬品シェアは、2017年度で69.9%とのことである。四半期での分析結果では、2017年度第4四半期(30 年1月~同3月)に74.1%に達したとされている。2015年4月に公表された「後発医薬品のさらなる使用促進のためのロードマップ」では、2018年3月までに60%以上と、新たな数量シェアによる目標値がはじめて設定されたが、当初の目標よりかなり早いペースでジェネリック医薬品の使用が進んできた。現在は、2020年9月までに80%とすることになっている。
日本ジェネリック製薬協会(JGA GE薬協)の最新の統計によると、わが国のジェネリック医薬品シェアは、2017年度で69.9%とのことである。四半期での分析結果では、2017年度第4四半期(30 年1月~同3月)に74.1%に達したとされている。2015年4月に公表された「後発医薬品のさらなる使用促進のためのロードマップ」では、2018年3月までに60%以上と、新たな数量シェアによる目標値がはじめて設定されたが、当初の目標よりかなり早いペースでジェネリック医薬品の使用が進んできた。現在は、2020年9月までに80%とすることになっている。
現行の数量シェアの計算方法や目標値設定は、中央社会保険医療協議会(中医協)薬価専門部会における平成24(2012)年度改定のための議論がベースになっている。当初の目標値は、欧州でも医薬品使用量の多い米英仏独にイタリア、スペインを加えた6カ国を参考に60%という値が設定された。この議論に筆者は、参考人として発言する機会があったが、目標値設定をマラソンにたとえ、「トップランナー(米独英)を目指すのではなく、まずは、目前のフランス、スペインを目指してはどうか」というような発言をした記憶がある。
その後、毎年実施されているロードマップ検証検討事業でも、IMS Health(2018年4月にIQVIAに社名変更)データにより、上記6カ国との数量シェアの比較が行われている。2017年の推計値では、日本62%、フランス68%、スペイン64%と、目標とした2カ国にほぼ肉薄するまで迫っている。同データによれば、米国92%、ドイツ87%、英国77%であり、いずれ、数量シェアも頭打ちになることが予想され、数量シェアの次の論点を考えなくてはならない。
ところで、欧米のジェネリック医薬品業界団体がそれらの名称を変更している。欧州では、EuropeanGenerics Medicines Association (EGA)が2016年3月 にMedicines for Europeに 1)、米国では、Generic Pharmaceutical Association (GPhA) が 2017 年 2 月 Association for AccessibleMedicines(AAM)に2)、という変更を行っている。Medicines for Europeの名称変更の理由は、(1)ジェネリック医薬品の普及により患者アクセスの向上と財政の効率化、(2)バイオシミラーのさらなる普及の重要性、(3)付加価値医薬品(value added medicine)の開発と供給など、業界のスコープの広がりがあったとされる。AAMでも、ジェネリック医薬品とともにバイオシミラーによる患者中心の医療とコスト解決策等を理由に挙げている。
わが国でも、ジェネリック医薬品をめぐる環境は変化している。バイオ医薬品だけでなく、低分子(化学合成)医薬品には高額な医薬品もあり、患者の経済的負担は経済的・心理的なアクセス阻害要因となりうる。また、「国民皆保険の持続性」と「イノベーションの推進」の両立が重視されているが、ジェネリック医薬品とバイオシミラー普及による薬剤費節約がなければ、これらを両立することは不可能である。
ジェネリック医薬品の付加価値製品については、日本は、欧州より進んだ開発が行われてきているといえるが、バイオシミラーの使用促進については、今後、バイオシミラーへの理解を進めていくことが重要で、低分子ジェネリックとは異なる取り組みも必要である。
もう一つ、今後日本のジェネリック医薬品産業が考えるべき新たな役割があると思われる。今回(平成30(2018)年度)の薬価制度改革は、新薬メーカーの産業育成の視点が強く反映されており、長期収載品に依存した企業体質から脱却し、よりイノベーティブな新薬開発を求めている。その結果、ジェネリック医薬品が上市されて一定期間を経た長期収載品の新たな薬価引下げルールの導入とともに、「退出」する道筋も示されている。
これまで長期収載品を扱う企業は、特許が切れた後も、実質的に、情報収集・提供等の機能を担ってきたが、厚労省のスキームでは、特定のジェネリック医薬品メーカーが、薬価上の「評価」を受けることになっており、情報収集等の役割を担うことになる。しかしながら、特許切れとなった成分についての情報を特定の1社が担うという仕組みがベストな解決策といえるのだろうか。業界団体や学会がその役割を担うべきと考えている。
いずれにしても、今後、ジェネリック医薬品メーカーも長期収載品を扱うことになるし、先発企業の中には、長期収載品ビジネスから撤退し、商社系企業に事業売却するところも出てきている。医薬品ビジネスの経験がないところが、生命関連の医薬品情報に責任を持てるかとの疑念もある。そこで、業界団体としてジェネリック医薬品、長期収載品という切り分けをせず、トータルに特許切れ後の「成分」に対する責任をもつべきではなかろうか。
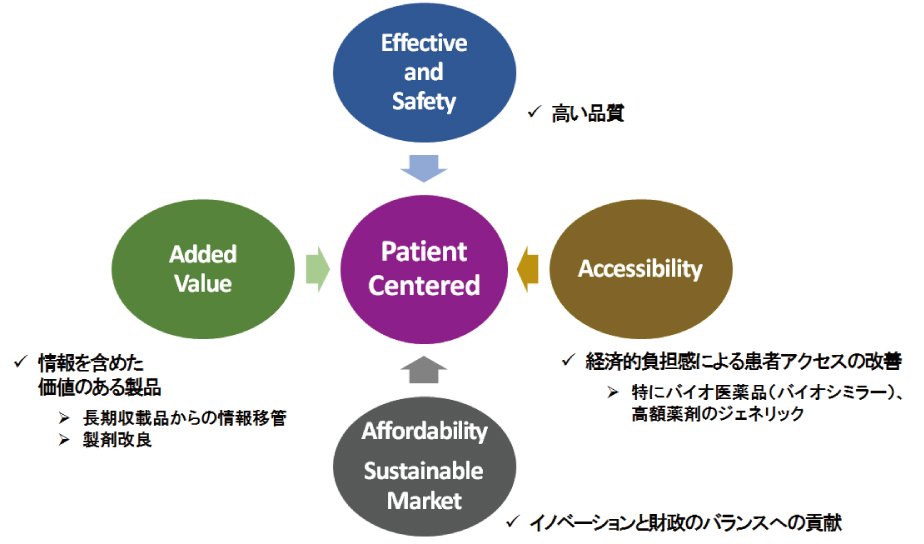
これからのジェネリック医薬品に関わる議論は、患者中心という基本的な視点に、先発品と同等の有効性・安全性というこれまでの使命に加え、安価なジェネリック医薬品・バイオシミラーによる患者アクセスの向上と、財政への貢献、そして特許切れ製品の情報を含めた付加価値の議論が必要と思われる(図)。
日本ジェネリック製薬協会としては、これまでのジェネリック医薬品、付加価値製品に加え、今後、バイオシミラー、長期収載品も含めた特許切れ成分まで議論の範囲とすべきと考える。その意味で、日本ジェネリック製薬協会という名称から、より幅広いスコープを包含する名称に変更してはどうだろうか。
図 患者中心の医療と特許切れ製品市場
1) Medicines for Europe :
https://www.medicinesforeurope.com/news/ega-becomes-medicines-for-europe/
2) Association for Accessible Medicines:
https://www.drugstorenews.com/pharmacy/gpha-changes-name-association-accessible-medicines/
JGAニュースNo.124(2019年8月号)





